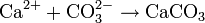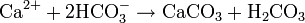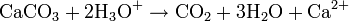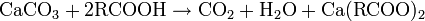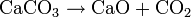- E-170
-
Carbonate de calcium
Carbonate de calcium 
Général Nom IUPAC Carbonate de calcium
blanc de Meudon
C.I. 77220
C.I. Pigment White 18Synonymes Calcite No CAS No EINECS PubChem No E E170(i) SMILES InChI Apparence poudre ou cristaux sans goût, sans odeur.[1] Propriétés chimiques Formule brute CaCO3 Masse molaire 100,087 g∙mol-1
C 12 %, Ca 40,04 %, O 47,96 %,Propriétés physiques T° fusion (décomposition) : 825 °C[1] T° ébullition décomposition Solubilité dans l'eau : nulle[1] Masse volumique (eau = 1) : 2.7-2.9[1] Thermochimie S0solide 93 J/mol·K ΔfH0liquide -1154 kJ/mol ΔfH0solide -1207 kJ/mol Précautions SIMDUT[2] Produit non contrôlé Unités du SI & CNTP, sauf indication contraire. Le carbonate de calcium (CaCO3) est composé d'un ion carbonate (CO32-) et d'un ion calcium (Ca2+), sa masse molaire est de 100 g/mole.
C'est le composant principal du calcaire et de la craie, mais également du marbre. C'est aussi le principal constituant des coquilles d'animaux marins, le corail et des escargots.
Le carbonate de calcium cristallise naturellement avec deux formes cristallines principales: l'aragonite et la calcite. Les deux autres formes cristallines sont plus rares: la vatérite & un hexahydrate, forme intermédiaire peu stable qui évolue vers la calcite. Il peut se présenter, dans les processus de cristallisation, sous forme de colloïde contenant de fins cristaux des formes plus stables.
L'ion bicarbonate est à la base de la formation du carbonate de calcium (CaCO3) qui est insoluble dans l'eau et est le constituant principal du calcaire :
(H2CO3 est l'acide carbonique)
Par contre, en milieu acide, le carbonate de calcium se transforme en bicarbonate de calcium (Ca(HCO3)2 ou Ca2 + , 2 HCO3−), très soluble dans l'eau.
C'est donc formellement un sel, d'une base faible (Ca(OH)2 - pKa = 12,6) et d'un acide faible (H2CO3 - pKa = 6,35), capable de réagir avec les acides pour donner des sels de calcium, de l'eau et du dioxyde de carbone, qui est à la pression atmosphérique et à température ambiante, gazeux et volatil :
À partir de 800 °C, il se forme une réaction de décomposition fortement endothermique :
CaO est la chaux vive, qui fait l'objet d'une importante industrie. C’est d'ailleurs pour cette réaction que le carbonate de calcium porte, dans certaines industries, le nom de carbonate de chaux, qui était l'ancien nom avant que le calcium ne soit isolé.
Sommaire
Chimie de l'état naturel
Le carbonate de calcium est très faiblement soluble dans l’eau pure (de l'ordre de 15 à 20 mg/l à 25 °C), mais soluble dans l’eau chargée de dioxyde de carbone. Or la solubilité des gaz dans l’eau augmente avec la pression et, contrairement à celle de la plupart des solides, diminue lorsque la température augmente. Ceci explique certains phénomènes naturels.
- Par exemple, le carbonate de calcium se dépose dans les chaudières et sur le fond des bouilloires. Il se dépose aussi à la sortie des robinets, où la pression diminue brusquement.
- Certaines sources, appelées pétrifiantes, aux eaux très riches en dioxyde de carbone, contiennent une très grande quantité de carbonate de calcium. En arrivant à l’air libre, elles perdent leur dioxyde de carbone et déposent en partie le carbonate dissout. Des objets exposés quelques jours à l’action de ces eaux se trouvent incrustés dans une couche de calcite.
- Un phénomène analogue explique les concrétions des grottes. L’eau, chargée de dioxyde de carbone, dissout le calcaire des roches qu’elle traverse et, en arrivant au contact de l’air, plus chaud, des cavités, elle dépose la calcite transportée. Celle-ci s’accumule en stalactites aux endroits où l’eau se détache du plafond ou en stalagmites aux endroits où les gouttes d’eau tombent sur le sol.
La biochimie de la sécrétion de leur coquille par les mollusques, et de la formation du squelette chez les animaux, n'est pas encore totalement comprise. Mais il est probable que la teneur des gaz en dissolution joue un rôle primordial.
Et sur Mars ?
Le carbonate de calcium est sur la planète Terre, un marqueur fort de la présence passée et actuelle de la vie. Sur Mars, voilà plusieurs décennies que des engins automatiques, en orbite ou en surface, tentent d'en détecter la présence. Sans succès jusqu'à la sonde américaine Phoenix Mars Lander, qui selon un communiqué de la NASA datant du 29 septembre 2008, aurait grâce à ses instruments TEGA et MECA, découvert dans le sous-sol, la présence de carbonate de calcium.
Bibliographie
- Le Carbonate de Chaux, J. DEDEK, Librairie Universitaire Louvain , 1966
Liens externes
- Eaux pétrifiantes http://natura2000.environnement.gouv.fr/habitats/HAB7220.html
- Concrétions http://www.grandroc.com/geologie.htm
- CARBONATE DE CALCIUM
Références
- ↑ a , b , c et d CARBONATE DE CALCIUM, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « Carbonate de calcium » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Portail de la chimie
Catégories : Composé du calcium | Carbonate | Colorant alimentaire
Wikimedia Foundation. 2010.