- Dichroïsme Circulaire
-
Dichroïsme circulaire
On dit qu'un matériau présente un dichroïsme circulaire s'il absorbe différemment la lumière selon que sa polarisation est circulaire droite ou circulaire gauche.
La polarisation de toute onde lumineuse peut se décomposer en deux parties : l'une circulaire droite (PCD) et l'autre circulaire gauche (PCG). En présence de dichroïsme circulaire, l'une des deux composantes sera absorbée plus rapidement que l'autre. Cette propriété se rencontre plutôt dans les liquides et les solutions du fait de la structure des molécules. On suppose que c'est le cas pour le reste de l'article.
Le phénomène est découvert par le physicien français Aimé Cotton en 1896.
Sommaire
Théorie
L'absorbance du milieu dichroïque présente deux valeurs, associées respectivement aux deux polarisations circulaires : AG et AD. On définit alors la différence entre ces deux absorbances :
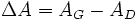 .
.
Cette grandeur dépend de la longueur d'onde, c'est-à-dire de la couleur de l'onde lumineuse utilisée.
On peut aussi exprimer l'égalité ci-dessus à l'aide de la loi de Beer-Lambert :
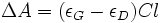 ,
,
où
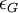 et
et 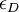 sont les absorptivités molaires respectives de la lumière PCG et PCD, C est la concentration molaire, et l est la longueur traversée.
sont les absorptivités molaires respectives de la lumière PCG et PCD, C est la concentration molaire, et l est la longueur traversée.On définit alors le dichroïsme circulaire par :
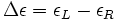 .
.
Cependant la grandeur mesurée n'est pas directement cette dernière. En effet, il est seulement possible de mesurer l'ellipticité θ grâce à des polariseurs. Cette ellipticité est un angle correspondant à la forme de la polarisation de la lumière : si la polarisation est rectiligne alors
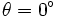 , et si la polarisation est circulaire alors
, et si la polarisation est circulaire alors 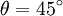 . Et au fur-et-à-mesure que la lumière avance dans la solution dichroïque, sa forme se rapproche petit à petit vers un cercle. Autrement dit, son ellipticité s'approche de 45°.
. Et au fur-et-à-mesure que la lumière avance dans la solution dichroïque, sa forme se rapproche petit à petit vers un cercle. Autrement dit, son ellipticité s'approche de 45°.Pour relier l'ellipticité mesurée au dichroïsme circulaire, on a recours à une approximation très souvent vérifiée : on suppose que l'effet de ce dichroïsme est faible, c'est-à-dire
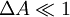 . Dans ce cas, on peut montrer que :
. Dans ce cas, on peut montrer que :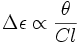 .
.
Et en définissant l'ellipticité molaire par :
![[\theta]=\frac{100\theta}{Cl}](/pictures/frwiki/53/561247c32f15a63a5e8ef80028b676b1.png) ,
,
on obtient la relation directe entre la quantité mesurée et le dichroïsme circulaire :
Application aux molécules biologiques
En général le dichroïsme circulaire apparaît dans toute molécule optiquement active. En conséquence, cela apparaît dans les molécules biologiques du fait de leur chiralité. C'est le cas de certains sucres et acides aminés. Leur structure secondaire joue également un rôle sur leur dichroïsme, en particulier les structures en hélice. C'est cette dernière propriété qui est utilisée en biochimie. Ainsi, les structures en hélice alpha et feuillet bêta des protéines et en double hélice des acides nucléiques présentent des dichroïsmes circulaires caractéristiques.
D'après la mécanique quantique, le dichroïsme circulaire est lié à la dispersion du pouvoir rotatoire, c'est-à-dire au fait que celui-ci dépende de la longueur d'onde. Tandis que ce dernier est mesuré loin des bandes d'absorption des molécules utilisées, le dichroïsme circulaire est mesuré proche de ces bandes. Il est possible, en principe, de passer de l'un à l'autre grâce à des transformations mathématiques.
La répartition spectrale du dichroïsme circulaire donne, dans le domaine des ultraviolets, des informations importantes sur la structure secondaire des protéines. Par exemple, cela indique la proportion de la protéine dans les conformations en hélice alpha, en feuillet bêta, en coudes, en structure aléatoire (random coil en anglais) etc. Il est aussi possible d'observer la dénaturation d'une protéine par l'augmentation du signal correspondant à la structure aléatoire et la diminution des signaux hélice alpha et feuillet bêta. On peut également suivre le repliement de la protéine (processus inverse de la dénaturation) et déterminer quelle structure secondaire se forme en premier (il s'agit souvent des structures en hélices alpha).
Ces informations permettent de réduire énormément les possibilités de structure de la protéine étudiée, mais elles ne donnent pas les emplacements des structures secondaires détectées. Cependant, le dichroïsme circulaire est un outil très efficace pour observer les modifications des conformations. Par exemple, il peut être utilisé pour montrer que la structure secondaire change en fonction de la température ou en fonction de la présence d'autres molécules. Dans ce sens, il révèle d'importantes informations sur l'aspect thermodynamique de la molécule. On peut également l'utiliser pour vérifier que la molécule étudiée est bien dans son état naturel, ou pour réaliser d'autres mesures spectroscopiques non liées à ces conformations.
Le dichroïsme circulaire donne moins d'informations sur la structure des protéines que la diffractométrie de rayons X ou la RMN de protéines, mais il permet de faire des mesures rapidement, sans nécessiter une grande quantité de protéines, et sans analyse compliquée des données. Ainsi, il permet d'étudier rapidement les protéines en faisant varier les conditions du solvant, la température, le pH, la salinité, etc.
Limitations expérimentales
Le dichroïsme circulaire a été étudié chez les glucides, mais avec un succès limité du fait des bandes d'absorption de ces molécules qui se trouvent dans une région des ultraviolets (100-200nm) difficile d'accès.
Une autre difficulté réside dans le fait que les solutions tampon typiques absorbent souvent la lumière dans la gamme de pH favorable au dichroïsme circulaire. Ainsi, les tampons de phosphates, de sulfates, de carbonates et d'acétates sont souvent inutilisables. On préfère alors utiliser le borate et les sels d'ammonium. Quelques expérimentateurs ont remplacé, pour les mêmes raisons, les ions fluorure par les ions chlorure. Certains ont simplement travaillé avec de l'eau. Mais il est souvent nécessaire d'utiliser des cuves très fines pour limiter ces absorptions parasites. Des longueurs de 0.1 mm ne sont pas rares.
Les spectres de dichroïsme circulaire utilisés dans la détection de la structure secondaire sont liés à l'absorption entre les orbitales π et π* des liaisons peptidiques. Ces bandes d'absorption résident en partie dans la partie difficile d'accès des ultraviolets. Cette partie est inaccessible dans l'air à cause de la forte absorption de l'oxygène dans cette gamme de longueurs d'ondes. Dans la pratique, on réalise les mesures à l'aide d'instruments remplis d'azote, et sans oxygène.
Une fois que l'oxygène est éliminé, il faut optimiser le reste du système afin de limiter les pertes. Par exemple, les miroirs doivent être couverts d'aluminium, et optimisés pour la zone du spectre voulue (UV lointain).
La source habituelle de lumière dans ce type d'instruments est une lampe à décharge haute-pression à xénon. Ce type de lampes est inutilisable dans l'UV lointain. Il faut utiliser des lampes spécialement fabriquées avec des enveloppes de verre de quartz synthétique très pur. La lumière d'un synchrotron est encore plus intense dans ce domaine, et a été utilisée pour effectuer des mesures de dichroïsme circulaire jusqu'à des longueurs d'ondes de l'ordre de 160 nm.
Voir aussi
Références
- Fasman, G.D., Circular Dichroism and the Confromational Analysis of Biomolecules (1996) Plenum Press, New York.
- Hecht, E., Optics 3rd Edition (1998) Addison Wesley Longman, Massachusetts.
- Portail de la physique
- Portail de la biochimie
Catégories : Grandeur physique | Optique ondulatoire | Méthode de la biochimie | Protéomique
Wikimedia Foundation. 2010.


![[\theta] = a \; \Delta\epsilon](/pictures/frwiki/98/b7b2d4e22303a1890df2c5b0b7fab888.png) avec
avec