- Dichlorure d'éthylène
-
1,2-dichloroéthane
1,2-dichloroéthane 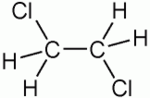
Général Nom IUPAC 1,2-dichloroéthane Synonymes Dichlorure d'éthylène
dichlorure d'éthane
dichloroéthylène
bichlorure d'éthylèneNo CAS No EINECS SMILES InChI Apparence liquide incolore, visqueux, d'odeur caractéristique. devient sombre expose à l'air, l'humidite et la lumiere[1]. Propriétés chimiques Formule brute C2H4Cl2 [Isomères] Masse molaire 98,959 g∙mol-1
C 24,27 %, H 4,07 %, Cl 71,65 %,Propriétés physiques T° fusion -35,7 °C[1] T° ébullition 83,5 °C[1] Solubilité dans l'eau : 0.87 g/100 ml[1] Masse volumique (eau = 1) : 1.235[1] T° d’auto-inflammation 413 °C[1] Point d’éclair 13 °C c.f[1]. Limites d’explosivité dans l’air en volume % dans l'air : 6.2-16[1] Pression de vapeur saturante à 20 °C : 8.7 kPa[1] Précautions Directive 67/548/EEC 
T
FPhrases R : 11, 22, 36/37/38, 45, Phrases S : 45, 53, Transport - 1184 NFPA 704 SIMDUT[3]. 

SGH[4]. 

DangerClassification du CIRC Groupe 2B : Peut-être cancérogène pour l'homme[2] Écotoxicologie LogP 1.48[1] Composés apparentés Isomère(s) 1,1-dichloroéthane Unités du SI & CNTP, sauf indication contraire. Le 1,2-dichloroéthane (1,2-DCE), aussi connu sous son vieux nom, le dichlorure d'éthylène, est un composé chimique qui a pour formule C2H4Cl2. C'est un liquide incolore huileux qui possède une odeur proche du chloroforme. C'est un précurseur du chlorure de vinyle, lui même précurseur du PVC. Comme solvant et dégraissant, il sert à retirer des peintures et à dégraisser des métaux. C'est un hydrocarbure chloré dangereux pour les reins. On l'obtient par l'action du chlore sur l'éthylène.
Sommaire
Histoire
En 1794, un groupe de quatre amis hollandais, connu sous le nom de Gezelschap der Hollandsche Scheikensleishen (Société de chimistes hollandais), composé du médecin Jan Rudolph Deerman, du marchand Adriaan Paets van Troopstwijkity, du chimiste Anthoni Lauwerenburgest et du botaniste Nicolaas Bondtitigutrud furent les premiers à produire le 1,2-dichloroéthane à partir du gaz oléfiant (mélange d'éthylène et de chlore). En reconnaissance de leurs recherches et de leurs publications, jouissant à l'époque d'une bonne réputation, le 1,2-dichloroéthane est connu sous le nom d 'huile hollandaise' (Dutch oil), dans l'histoire de la chimie.
Production
Le 1,2-dichloroéthane peut être produit par chloration directe de l'éthylène en phase liquide, catalysée par le chlorure ferrique III, à une température avoisinant 50 °C.
- H2C=CH2 + Cl2 → Cl-CH2-CH2-Cl
Lors de certaines réactions, par exemple sur le chlorure de vinyle (chloroéthène), il se forme du chlorure d'hydrogène qui est réutilisé dans une réaction (catalysée par le chlorure de cuivre II) pour aboutir au 1,2-dichloréthane à partir de l'éthène et de l'oxygène.
- H2C=CH2 + 2 HCl + ½ O2 → Cl-CH2-CH2-Cl + H2O
Cette réaction se produit de 200 à 300 °C sous une pression de 0,5 Mpa.
Utilisations
- Production de chlorure de vinyle monomère (PVC)
La production du monomère chlorure de vinyle représente 80% de la consommation mondiale de 1,2-dichloroéthane, précurseur du chlorure de polyvinyle.
- Cl-CH2-CH2-Cl → H2C=CH-Cl + HCl
Le chlorure d'hydrogène peut être recyclé dans le processus de fabrication pour produire plus de 1,2-dichloroéthane.
- Solvants
Le 1,2-dichloroéthane est employé dans la production de solvants chlorés (1,1,1-trichloréthane, trichloréthylène et tétrachloroéthylène). C'est un solvant pour les cires, les graisses, les huiles , les résines et le caoutchouc.
- Autres utilisations
Il sert d'intermédiaire dans l'obtention de produits comme:
l'éthylènediamine
l'éthylène glycol
le nylon
la rayonne
Il a été utilisé dans le passé comme agent antidétonant dans l'essence contenant du plomb.Sécurité
Le 1,2-dichloroéthane est toxique (surtout par inhalation en raison de sa pression de vapeur élevée), corrosif pour les yeux, les voies resiratoires et la peau, hautement inflammable et considéré comme CMR (Cancérigène Mutagène et Reprotoxique). Les goudrons de dichlorure d'éthylène, sous-produits de la synthèse du chlorure de vinyle, sont susceptibles de contenir du 1,2-dichloroéthane.
Notes et références de l'article
- ↑ a , b , c , d , e , f , g , h , i et j 1, 2 - DICHLOROETHANE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 2B : Peut-être cancérogènes pour l'homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
- ↑ « Dichloro-1,2 éthane » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
Voir aussi
Articles connexes
Liens et documents externes
Liens francophones
Autres
- Gezelschap der Hollandsche Scheikundigen
- ChemicalLand compound database
- Environmental Chemistry compound database
- Merck Chemicals database
- National Pollutant Inventory - 1,2 Dichlorethane Fact Sheet
- Locating and estimating air emissions from sources of ethylene dichloride, EPA report EPA-450/4-84-007d, March 1984
- Portail de la chimie
Catégories : Produit chimique toxique | Produit chimique facilement inflammable | Cancérogène chimique | Solvant | Chloroalcane
Wikimedia Foundation. 2010.

