- Acide acétylacétique
-
Acide acétylacétique 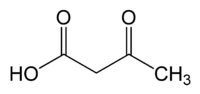
Général Nom IUPAC acide 3-oxobutanoique No CAS Propriétés chimiques Formule brute C4H6O3 [Isomères] Masse molaire[1] 102,0886 ± 0,0045 g·mol-1
C 47,06 %, H 5,92 %, O 47,02 %,pKa 3,77 Propriétés physiques T° fusion 36,5 °C Unités du SI & CNTP, sauf indication contraire. L'acide acétylacétique est un acide carboxylique de formule brute C4H6O3, qui intervient dans le métabolisme des lipides. C'est le plus simple des beta-cétoacides et, comme les autres membres de cete classe, il est assez instable.
Sommaire
Propriétés
L'acide acétylacétique est un acide faible (comme la plupart des acides carboxyliques) avec un pKA de 3,77. Il peut être préparé saponification de l'acétoacétate d'éthyle (suivi par un acidification)[2].
En général, l'acide acétylacétique est préparé à 0 °C et utilisé in situ immédiatement après[3]. Il se décompose à vitesse moyenne en acétone et en dioxyde de carbone :
- CH3C(O)CH2CO2H → CH3C(O)CH3 + CO2
La forme acide a une durée de demi-vie de 140 minutes à 37 °C dans l'eau, alors que la forme basique (l'anion) en a une de 130 heures car il réagit au moins 50 fois plus lentement[4].
Détection
Quand la quantité des corps cétoniques est mesurée via leur concentration dans les urines, ce sont en fait l'acide acétylacétique, l'acide beta-hydroxybutanoïque (BHB) et l'acétone qui sont détectés. On utilise pour cela des lamelles recouvertes de nitroprusside ou un réactif similaire. Le nitroprusside passe du rose au violet en présence d'acétylacétate, la base conjuguée de l'acide acétylacétique, le changement de couleur étant observé par rapport à une grille de couleurs.
Notes et références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Robert C. Krueger, « Crystalline Acetoacetic Acid », dans Journal of the American Chemical Society, vol. 74, no 21, 1952, p. 5536–5536 [lien DOI]
- George A. Reynolds and J. A. VanAllan "Methylglyoxal-ω-Phenylhydrazone" Organic Syntheses, Collected Volume 4, p.633 (1963).http://www.orgsyn.org/orgsyn/pdfs/CV4P0633.pdf
- Hay, R. W.; Bond, M. A., « Kinetics of decarboxilation of acetoacetic acid », dans Aust. J. Chem., vol. 20, no 9, 1967, p. 1823–8
Voir aussi
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Acetoacetic acid » (voir la liste des auteurs)
Wikimedia Foundation. 2010.
