- Carbonate d'hydrogène
-
Acide carbonique
Acide carbonique 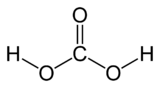
Général Nom IUPAC acide carbonique No CAS Propriétés chimiques Formule brute H2CO3 Masse molaire 62,0248 g∙mol-1
C 19,36 %, H 3,25 %, O 77,39 %,pKa 6,37 et 10,32 (diacide) Propriétés physiques Solubilité Sol. dans l'eau Unités du SI & CNTP, sauf indication contraire. L'acide carbonique est un acide faible de formule chimique H2CO3.
Sommaire
Description
Il est produit par réaction entre l'eau et le dioxyde de carbone. C'est une molécule instable, une solution aqueuse de dioxyde de carbone ne contient que très peu d'acide carbonique. C'est le cas par exemple dans l'eau gazéifiée ou le sang.
En solution dans l'eau, l'acide carbonique peut perdre un ou deux protons (ou ion H+). Retirer le premier proton forme l'ion hydrogénocarbonate; retirer le second proton mène à l'ion carbonate.
- H2CO3 → HCO3- + H+ (pKa = 6,37)
- HCO3- → CO32- + H+ (pKa = 10,32)
Quand l'acide carbonique est combiné avec un cation, des sels nommés carbonates ou bicarbonates peuvent se former. Par exemple, combiné avec de la chaux (oxyde de calcium) il constitue du marbre ou de la craie (carbonate de calcium).
Rôle
Naturels
Avec l'augmentation des émissions de CO2 dans l'atmosphère, on peut remarquer une acidification des océans ; l'eau forme de l'acide carbonique en se mélangeant avec le CO2 absorbé par les océans. Cet acide dissout le carbonate de calcium, principal composé des coquillages (le plancton lui-même souffrirait de cette acidification).
Dans une forme diluée il joue un rôle majeur dans la formation des grottes.
Industrie alimentaire
L'acide carbonique est présent dans les limonades. Dans l’eau, CO2 forme l’acide carbonique, qui picote la langue, renforce le goût et agit comme un bactéricide doux. Il active le passage des aliments de l’estomac vers l’intestin.
Voir aussi
Articles connexes
- Portail de la chimie
Catégories : Oxoacide | Carbonate
Wikimedia Foundation. 2010.
