- CLHP
-
Chromatographie en phase liquide à haute performance
La chromatographie en phase liquide à haute performance — CLHP, mais on trouve plus fréquemment l'abréviation anglaise HPLC (high performance liquid chromatography) depuis les années 1990 — est une technique de séparation analytique en fonction de l'hydrophobicité et préparative des molécules d'un composé ou un mélange de composés. Pour certains, HP signifie « haute pression ».
Cette forme de chromatographie est fréquemment utilisée en biochimie, ainsi qu'en chimie analytique.
Sommaire
Principe
L'échantillon à analyser est poussé par un liquide (appelée phase mobile) dans une colonne remplie d'une phase stationnaire de fine granulométrie (les "grains" sont de très petite taille). Le débit d'écoulement de la phase mobile est élevé ce qui entraîne une augmentation de la pression dans le système. Ce débit élevé diminue le temps nécessaire pour séparer les composants le long de la phase stationnaire. La fine granulométrie de la phase stationnaire permet une meilleure séparation des composants. En effet, pour un même volume de phase stationnaire la surface d'échange augmente si les "grains" qui la composent sont de diamètre plus petit. Les pics obtenus sont plus étroits donc la résolution est améliorée (les pics sont bien séparés, on peut donc bien les différencier), le seuil de détection est également plus bas (des pics étroits et hauts sont plus faciles à isoler du bruit de fond que des pics larges et bas). La combinaison de ces attributs - rapidité et résolution élevées - conduit à l'appellation « haute performance ».
Les solvants utilisés sont des combinaisons miscibles d'eau et de divers liquides organiques (alcools, acétonitrile, dichlorométhane, ...).
Souvent, la composition de la phase mobile est modifiée au cours de l'analyse, c'est le mode dit "gradient" ou "élution graduée" (en opposition au mode "isocratique", pour lequel la composition de la phase mobile reste la même tout au long de l'analyse). Par exemple, sur une colonne apolaire, en utilisant un mélange eau/méthanol comme phase mobile, les composants les plus hydrophobes sont élués avec une concentration élevée en méthanol alors que les composants plus hydrophiles sont élués préférentiellement avec une concentration faible en méthanol. Selon la nature de la phase stationnaire, on commencera par une concentration élevée en méthanol ou le contraire.Appareillage et fonctionnement
La pompe
C'est la partie qui sert à stocker l'éluant et à l'injecter sous pression dans la colonne. Elle est composée de :
- Deux pistons alternatifs
- Réservoirs de phase mobile
- Électrovannes
- Amortisseur de pulsations
- Système de purge et d'amorçage
- Capteur de pression
On utilise une pompe pour une élution isocratique ou plusieurs pour une élution par gradient.
L'injecteur
Des tubes en acier inoxydable, en Teflon, en PEEK ou en silice fondue permettent de relier la ou les pompes à l'injecteur chromatographique. Il y a plusieurs types d'injecteurs :
- Boucle d'injection : permet la répétabilité du volume d'injection
- Injecteur seringue
- Extraction sur phase solide en ligne
La colonne
Elle dépend du type de chromatographie en phase liquide que l'on veut faire et donc de la nature et du nombre de composés que l'on veut séparer. Il peut y avoir plusieurs colonnes parallèles. Il y a donc plusieurs types de chromatographies en phase liquide :
La chromatographie d'adsorption
Article détaillé : Chromatographie d'adsorption.Dans cette chromatographie, la phase stationnaire consiste en une matière solide à grand pouvoir d'adsorption, tel que l'oxyde d'aluminium, les silicates de magnésium, les gels de silice. Les composants sont simplement plus ou moins retenus à la surface de la phase stationnaire par adsorption physique. C'est une technique qui prend en compte la polarité des composants.
La chromatographie de partage
Article détaillé : Chromatographie de partage.Dans cette chromatographie les analytes sont séparés en fonction de leur affinité avec les phases stationnaire et mobile. L'affinité dépend de la polarité des analytes et des phases. En mode normal la phase stationnaire est polaire, en mode inverse elle est apolaire. Il y a deux types de chromatographie de partage :
- liquide - liquide : la phase stationnaire consiste en une très fine couche de liquide répartie par adsorption physique à la surface du matériau support le plus inerte possible. Les composants sont séparés comme dans une extraction liquide-liquide, sauf que la répartition des composants se fait lors du passage dans la phase liquide et non par agitation.
- liquide - solide ou liquide - phase greffée : la phase stationnaire consiste en une espèce organique liée par des liaisons chimiques à la surface des particules du matériau support.
La chromatographie par échange d'ions
Article détaillé : Chromatographie à échange d'ions.La phase solide est une résine insoluble munie de groupes fonctionnels capable de dissocier. Ce sont, habituellement, des groupes "acide sulfonique" (SO3H) pour les échangeurs de cations et "ammonium quaternaire" (N(R)3) pour les échangeurs d'anions.
La chromatographie d'exclusion stérique
Article détaillé : Chromatographie d'exclusion stérique.Les composants sont séparés selon leur dimension moléculaire. La phase stationnaire est composée d'un matériau poreux (petites particules de silice ou de polymères), les molécules dont le diamètre est supérieur à celui des pores ne peuvent pénétrer et ne sont pas retenues. La durée de séjour dans la colonne augmente lorsque la taille des analytes diminue.
La chromatographie chirale
Article détaillé : Chromatographie chirale.Cette technique de chromatographie consiste en la formation de liaisons non covalentes entre les énantiomères du substrat et l'absorbant chromatographique chiral donnant des complexes diastéréoisomères ayant des affinités de liaisons différentes. Elle sert donc en particulier à séparer des énantiomères.
Le détecteur
Il existe plusieurs types de détecteurs :
- Détecteur à absorption UV ou visible
- Détecteur à indice de réfraction
- Détecteur UV à barrette de diodes (DAD)
- Détecteur à fluorescence
- Détecteur de type spectromètre de masse (MS)
- Détecteur évaporatif à diffusion de la lumière (DEDL)
Les différentes phases stationnaires
Phase normale
Les colonnes en phase normale sont des colonnes dont la phase stationnaire est polaire et acide.
La phase normale la plus utilisée est à base de gel de silice : à sa surface se trouvent des groupes silanols (-OH) et des groupes siloxanes (-O-). Ces groupes permettent à la silice de retenir les composés à analyser par des liaisons hydrogènes.
Cette phase sert ainsi principalement à séparer des composés polaires.
Phase inverse
La base d'une phase inverse est une phase normale sur laquelle des chaînes alkyles (ou autres selon la polarité recherchée) ont été greffées au niveau des groupes silanols (end-capping). En général, la phase stationnaire est majoritairement composée de petites particules de silice sur lesquels on a greffé des fonctions chimiques, le plus souvent de chaines alkyles à 8 ou 18 atomes de carbones.
Les fonctions silanols (Si-OH) qui subsistent engendrent des interactions hydrophiles parasites, qui rendent les résultats non reproductibles surtout pour les molécules basiques. Pour éviter cela, la surface de la silice est généralement recouverte par une fonction méthyle et les fonctions silanols ne sont plus libres mais sous la forme (Si-O-CH3), c'est cette étape que l'on appelle "end-capping". Les fonctions chimiques utilisées pour le "end-capping" peuvent toutefois être de nature très diverses et les colonnes de dernières générations résistant à des pH extrêmes sont généralement "end-capped" avec des fonctions proposant une plus grande gène stérique, tel que le tert-butyle (Si-O-C(CH3)3).Selon le taux de greffage, on obtient une plus ou moins grande résolution.
Cette phase stationnaire est dite "inverse" car de polaire et hydrophile (sans les "greffes"), la phase devient apolaire et hydrophobe.
Paramètres de chromatographie
La qualité et la durée d'une séparation peuvent changer avec la nature de la phase stationnaire et de la phase mobile utilisées. Mais pour un même type de phase stationnaire et une même phase mobile, la qualité et la durée d'une séparation peuvent aussi être modifiées par les caractéristiques géométriques et opératoires de ces deux phases.
Caractéristiques géométriques de la phase stationnaire
- la longueur L et le diamètre interne dc de la colonne
- le diamètre des particules de phase stationnaire dp
Caractéristiques opératoires de la phase mobile
- la vitesse linéaire de l'écoulement u
- la perte de charge ou pression appliquée ΔP entre l'entrée et la sortie de la colonne (la pression de sortie étant généralement atmosphérique). Elle est donnée par la loi de Darcy
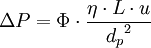
où η est la viscosité de la phase mobile et Φ est le facteur de résistance à l'écoulement qui dépend de la forme des particules et de la qualité du remplissage de la phase stationnaire.
Pour des colonnes bien remplies de particules sphériques ou irrégulières, la formule empirique suivante, établie avec les unités usuelles, permet le calcul commode d'une estimation de ΔP en fonction du débit F de la phase mobile avec une incertitude inférieure à 25%
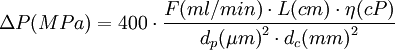
Remarque : la loi de Darcy est à l'hydraulique ce que la loi d'Ohm est à l'électricité. La pression hydraulique est analogue au potentiel électrique, le débit de liquide est analogue à l'intensité du courant, la perméabilité hydraulique est analogue à la conductivité électrique, la pressurisation et la dépressurisation d'une colonne chromatographique sont respectivement analogues à la charge et à la décharge d'un condensateur électrique.Grandeurs caractéristiques en chromatographie
Le résultat observable d'une analyse HPLC se présente sous la forme d'une courbe du signal détecté en fonction du temps : c'est le chromatogramme. Il comporte plusieurs pics de forme gaussienne, de caractéristiques différentes :
- le temps de rétention ou tR, temps du maximum du pic. On appelle t0 ou temps de rétention nulle le temps correspondant à un composé non retenu chromatographiquement.
- la largeur du pic, mesurée à mi-hauteur : ω1/2, ou à sa base, par l'intersection des tangentes du pic à ses points d'inflexion avec la ligne de base : ω.
De là peuvent être calculées plusieurs caractéristiques de la colonne pour la séparation des pics :- le facteur de rétention k' du pic, par la formule
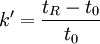
- l' efficacité N ou nombre de plateaux théoriques, reliée à la largeur du pic par la formule
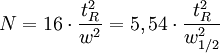
Cette valeur mesure la finesse du pic. À partir de cette valeur peut être calculée la hauteur équivalente à un plateau théorique (HEPT) H, qui permet de comparer des colonnes de longueur différente
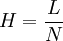
- la sélectivité α entre deux pics 1 et 2 (2 étant plus retenu que 1), définie par le rapport de leurs deux facteurs de rétention
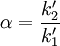
Elle mesure la capacité de la colonne à séparer les maxima des pics. Plus elle est supérieure à 1, plus les temps de rétention sont éloignés.- la résolution RS entre les pics 1 et 2
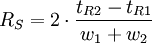
Cette valeur mesure la qualité de séparation et d'absence de recouvrement entre les 2 pics considérés.
La résolution ainsi définie est l'objectif de la séparation chromatographique. C'est une fonction des trois caractéristiques (efficacité, sélectivité et rétention), elles-mêmes définies ci-dessus, dont l'expression est
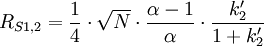
Cette expression montre notamment qu'une même résolution peut être obtenue dans des conditions chromatographiques ou bien très efficaces (optimisation cinétique) ou bien très sélectives (optimisation thermodynamique). Quoi qu'il en soit, la performance qui caractérise la technique HPLC est définie par le pouvoir de résolution par unité de temps, ce qui n'implique pas systématiquement l'utilisation de la pression la plus haute possible.
Voir aussi
- la chromatographie en phase liquide
- la Dhplc (Denaturing High Performance Liquid Chromatography) utilisée pour la recherche de polymorphismes dans l'ADN
- la chromatographie en phase gazeuse
- la chromatographie en phase supercritique
- la chromatographie chirale
- l'UPLC (Ultra Performance Liquid Chromatography)
- la chromatographie de partage
- Portail de la chimie
- Portail de la biochimie
Catégorie : Chromatographie
Wikimedia Foundation. 2010.
