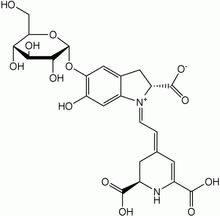
- Bétalaïne
-
Les bétalaïnes sont des pigments végétaux, dont la couleur varie d'un remarquable jaune foncé à un violet intense.
Sommaire
Source
Les bétalaïnes sont présentes dans la plupart des familles de plantes appartenant à l'ordre des Caryophyllales. L'exemple le plus connu de ces plantes est la betterave rouge (Beta vulgaris, appelée parfois de manière erronée carotte rouge), mais des fleurs aussi populaires que les belles de nuits (mirabilis), les cactus ( pitahaya[1], Figuier de Barbarie[2]), les bougainvilliers, les pourpiers[3] (Portulaca grandiflora) sont colorés par ces pigments. Certains champignons comme les Amanites (parmi lesquels l' Amanite tue-mouche - Amanita muscaria) et les Hygrocybes doivent leurs couleurs jaune ou rouge aux bétalaïnes.
Chimie
Le nom "bétalaïne" provient du nom latin de la betterave (Beta vulgaris), à partir de laquelle elles ont été la première fois extraites et caractérisées en 1958 par une équipe de l'Ecole Polytechnique Fédérale de Zürich[4].
Les bétalaïnes sont des hétérosides, une parties de la molécule (chromophore) est attachée à un ose (sucre simple). Le chromophore dérive de l'acide aminé tyrosine par une synthèse complexe faisant intervenir comme intermédiaire la dihydroxyphénylalanine (DOPA).
Il existe 2 catégories de bétalaïne[5] :
- Les bétacyanines, pigments de couleur rouge à violet (bétanine).
- Les bétaxanthines, pigments de couleur jaune à orange (indicaxanthine)[2].
La couleur et la stabilité des bétalaïnes dépendent du pH.
La plus étudiés des bétalaïnes est la bétanine (ou bétacyanine) aussi appelé rouge betterave car elle peut être isolée à partir de la betterave. Elle est commercialisée comme un colorant naturel pour colorer les aliments. Cependant le monde de l’agroalimentaire s'y intéresse pour ses propriétés antioxydantes[6] avec tous les bénéfices positifs pour la santé[2].
Les autres bétalaïnes connues sont l’amaranthine et l’isoamaranthine, toutes les deux isolées de plantes de la familles des Amaranthus.
Génétique moléculaire
La biosynthèse des bétalaïnes, à partir de l'acide aminé tyrosine, suit le schéma présenté dans la figure suivante: [1].
La réaction 1, dans laquelle la tyrosine est transformée en DOPA (3,4-dihydroxyphénylalanine), est catalysée par une phénoloxydase (groupe d'enzyme très répandues chez les plantes et les champignons).
La réaction 2, dans laquelle la DOPA est transformée en séco-DOPA et en acide bétalamique, est catalysée par une enzyme appelée 4,5-DOPA-dioxygénase (pour préciser le site d'ouverture du cycle on ajoute -4,5- ). Cette enzyme a été isolée et son gène cloné à partir du champignon Amanita muscaria[7]. Un gène codant une enzyme analogue a été cloné chez Portulaca grandiflora[8] La cyclo-DOPA est formée à partir de la DOPA (sous l'action d'une diphénolase). Les autres réactions (spontanées) sont responsables de la grande variété de couleurs des plantes à bétalaïnes. Les bétalaïnes sont glycosylées sous l'action d'enzymes[9].
L'analyse génétique[3] montre que chez le pourpier, seuls trois gènes sont nécessaires pour rendre compte toutes les colorations connues : C (pour couleur - codant une 4,5-DOPA-dioxygénase), I (gène qui module l'accumulation des produits d'une réaction spontanée[10] entre l'acide bétalamique et les amines présentes dans la cellule) et enfin R qui code probablement le gène responsable de la formation de la cyclo-DOPA.
Notes et références de l'article
- (en) FC Stintzing, A Schieber and R Carle (2002). Betacyanins in fruits from red-purple pitaya, Hylocereus polyrhizus (Weber) Britton & Rose. Food chemistry, vol. 77, no1, pp. 101-106
- (en) Luisa Tesoriere, Mario Allegra, Daniela Butera et Maria A. Livrea, « Absorption, excretion, and distribution of dietary antioxidant betalains in LDLs: potential health effects of betalains in humans », dans American Journal of Clinical Nutrition, vol. 80, no 4, 2004, p. 941-945 [texte intégral]
- (en) Trezzini GF, Zrÿd J-P (1990) Portulaca grandiflora: a model system for study of the biochemistry and genetics of betalain synthesis. Acta Horticulturae 280: 581-585
- (de) Wyler H, Vincenti G, Mercier M, Sassu G, Dreiding AS (1959) Zur Konstitution des Randenfarbstoffes Betanin.2. Helvetica Chimica Acta 42: 1696-1698
- (en) Frank B. Salisbury, Cleon W. Ross, Plant Physiology, Belmont, California, Wadsworth Publishing, 1991, 4the éd. (ISBN 978-0-534-15162-1) (LCCN 91007362), p. 325-326
- (en) J. Escribano, M. A. Pedreño, F. García-Carmona et R. Muñoz, « Characterization of the antiradical activity of betalains from Beta vulgaris L. roots », dans Phytochem. Anal., vol. 9, 1998, p. 124–127
- (en) Hinz, U.G., Fivaz J., Girod P.-A., Zryd J.-P., (1997) "The gene coding for the DOPA dioxygenase involved in betalain biosynthesis in Amanita muscaria and its regulation." Mol Gen Genet 256: 1-6
- (en) Laurent Christinet, Frédéric X. Burdet, Maia Zaiko, Ursula Hinz et Jean-Pierre Zryd, « Characterization and Functional Identification of a Novel Plant 4,5-Extradiol Dioxygenase Involved in Betalain Pigment biosynthesis in Portulaca grandiflora », dans Plant Physiology, vol. 134, no 1, 2004, p. 265-274 [texte intégral]
- (en) Kobayashi N, Schmidt J, Wray V, Schliemann W (2001) Formation and occurrence of dopamine-derived betacyanins. Phytochemistry 56: 429-436
- (en) Willibald Schliemann, N. Kobayashi et D. Strack, « The decisive step in betaxanthin biosynthesis is a spontaneous reaction », dans Plant Physiology, vol. 119, no 1, 1999, p. 1217-1232 [texte intégral]
Voir aussi
Articles connexes
Liens et documents externes
- Portail de l’alimentation et de la gastronomie
- Portail de la chimie
- Portail des couleurs
Wikimedia Foundation. 2010.