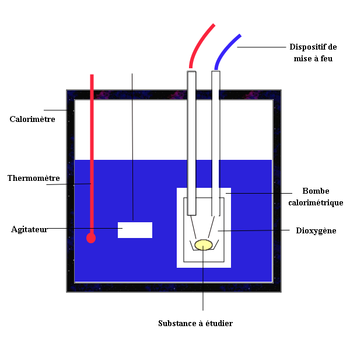
- Bombe calorimetrique
-
Bombe calorimétrique
Une bombe calorimétrique est un appareillage permettant de mesurer le dégagement de chaleur au cours d’une réaction effectuée à volume constant. Dans ces conditions la chaleur mise en jeu est égale à la variation de la fonction d'état énergie interne U du système réactionnel : ΔU = QV . La chaleur ne dépendant plus de la manière de procéder, on peut alors la déterminer.
On peut ainsi déterminer le pouvoir calorifique (en J/g) d'une substance.
La bombe calorimétrique a été mise au point par Pierre-Eugène Marcellin Berthelot en 1879 alors qu'il étudiait les phénomènes de combustion à volume constant.
Sommaire
Principe
Pour mesurer le pouvoir calorifique d'une substance, il faut déterminer la chaleur dégagée par cette substance lors d'une réaction de combustion complète, rapide et unique. Complète pour éviter les corrections difficiles à calculer si une partie de la substance ne s'est pas consumée, rapide pour éviter les déperditions de chaleur inévitables même si le système est isolé et unique pour que des réactions secondaires ne viennent pas perturber la mesure.
Le principe de fonctionnement de la bombe calorimétrique remplit ces trois conditions. Il s'agit d'un cylindre en acier, bon conducteur de la chaleur et très résistant à la pression qui peut atteindre instantanément après la réaction, plusieurs centaines de bar. On dispose au fond de ce cylindre un creuset dans lequel sera déposée la substance à étudier. Le cylindre est alors rempli de comburant (dioxygène à une pression de 20 à 30 bar pour être sûr qu'il sera en excès afin d'assurer une combustion complète). Le dispositif de mise à feu est constitué d'un fil métallique au contact de la substance, qui sera traversé par un courant de forte intensité pour déclencher la combustion. La bombe est placée dans un calorimètre comprenant une grande quantité d'eau distillée, muni d'un dispositif d'agitation et d'un thermomètre de précision. La quantité d'eau est importante pour que l'élévation de température ne dépasse pas quelques degrés.
Après avoir mesuré la température initiale, on déclenche la mise à feu puis on mesure la température de la fin de la combustion lorsque l'équilibre thermique du calorimètre est atteint (moment où la courbe de température redescend). Connaissant la capacité thermique du calorimètre, il est alors facile de déterminer la quantité de chaleur produite par la combustion en la corrigeant de la chaleur apportée par le système de mise à feu.
Précaution d'emploi
Une bombe calorimétrique doit être étalonnée avant chaque mesure. L'étalonnage s'effectue en réalisant la combustion d'un corps dont le
pouvoir calorifique est connu (généralement de l'acide benzoïque, pouvoir calorifique = 26 453 J.g-1). Cet étalonnage va permettre de déterminer la capacité thermique du calorimètre.
Une bombe calorimétrique peut contenir des gaz à fortes pressions. Il est donc nécessaire d'effectuer des contrôles de qualité nombreux pour éviter tout risque de fuite, voire d'explosion.
Application biologique
L'oxydation des nutriments se déroule dans le corps humain selon le même principe pour obtenir l'énergie nécessaire à la vie. Cependant le processus est moins rapide et moins intense, en effet les cellules ne pourraient pas résister à une augmentation brutale de température. On peut établir les équivalents énergétiques des différents aliments. Dans l'organisme, l'oxydation des protéines n'est pas aussi complète et elle aboutit à la formation d'urée, il faut alors soustraire la valeur énergétique de l'urée produite.
- lipide : 38 kJ/g (soit environ 9 kcal/g)
- glucide : 17 kJ/g (soit environ 4 kcal/g)
- protéine : 17 kJ/g (soit environ 4 kcal/g)
Voir aussi
- Portail de la chimie
Catégories : Thermochimie | Calorimétrie
Wikimedia Foundation. 2010.