- 3,3'-Dibromothymolsulfonphethaleine
-
Bleu de bromothymol
Bleu de bromothymol[1],[2] 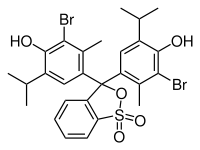
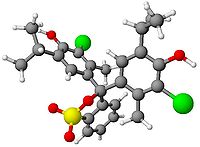
Formule éclatée et Modèle 3D de la molécule du Bleu de bromothymol Général Nom IUPAC 3,3',-Dibromothymolsulfonephthaléine; 4,4'-(3H-2,1 Benzoxathiol-3-ylidène) bis [2 bromo-3-méthyl-6-(1-méthyléthyl)phénol] S,S-dioxide No CAS
sel de sodium :No EINECS
(Na)SMILES InChI Apparence cristaux jaunes Propriétés chimiques Formule brute C27H28Br2O5S [Isomères] Masse molaire 624,381 g∙mol-1
C 51,94 %, H 4,52 %, Br 25,59 %, O 12,81 %, S 5,14 %,pKa 7,10[3] Propriétés physiques T° fusion 204 °C Solubilité 10 g/L dans l'eau à 19,9 °C
très soluble dans l'éthanol à 19,9 °CMasse volumique 1,25 g/cm³ (liquide) Précautions Directive 67/548/EEC Phrases S : 24/25, SIMDUT[4] Produit non contrôlé Unités du SI & CNTP, sauf indication contraire. Le bleu de bromothymol (ou BBT ou dibromothymolsulfonephthaléine, en anglais Bromothymol blue (BTB)) est un composé chimique souvent utilisé comme indicateur coloré de pH. En effet, il possède des propriétés halochromiques.
Sommaire
Structures
Le bleu de bromothymol est un des composés principaux de la famille des indicateurs colorés de pH qui dérivent du triphénylméthane.
Teintes du bleu de bromothymol
La forme acide est jaune (pH<6,0) et la forme basique est bleue (pH>7,6). Entre ces deux pH, une solution contenant ce composé est de couleur verte (mélange des deux couleurs). A l'instar du bleu de thymol, Le bleu de bromothymol possède aussi une seconde zone de virage[5], mais en milieu acide concentré (pH<0), il vire alors du jaune au fuchsia lorsque le pH diminue.
Couleurs du bleu
de bromothymolforme acide 1
fuchsiazone de virage
env. pH 0.0forme acide 2
jaunezone de virage
pH 6.0 à pH 7.6forme basique
bleu- Légende de l'image :
- Tube 2 : forme acide (jaune) du bleu de bromothymol (solution d'acide chlorydrique à 0,5 mol/L)
- Tube 4 : forme basique (bleu) du bleu de bromothymol (solution d'hydroxyde de sodium à 1 mol/L)
- Tube 3 : zone de virage du bleu de bromothymol (coexistence des formes acide et basique)
- Tube 1 : forme superacide du bleu de bromothymol (acide chlorhydrique concentré, pH négatif)
Utilisations
Les propriétés halochromiques du bleu de bromothymol sont utilisées pour suivre les changements de pH durant les dosages acido-basiques notamment. Sa zone de virage comprenant le pH neutre, ce sont les dosages entre acides et bases fortes qui nécessitent un indicateur tel que le BBT, le point équivalent se situant à un pH de 7.
En général, la zone de virage particulière du BBT permet d'indiquer rapidement si une solution est acide ou basique. Ce composé permet de détecter la présence de dioxyde de carbone, qui est un acide (acide carbonique H2CO3 ou H2O,CO2), par changement de couleur de bleu à jaune des cristaux.
Le bleu de bromothymol est par ailleurs aussi utilisé comme pigment pour la teinture.
Annexes
Notes et références
- ↑ Acros Organics, Reference Handbook of Fine Chemicals, p.340
- ↑ Fiche de données de sécurité Prolabo
- ↑ (en) David R. Line, Handbook of Chemistry and Physics 84th edition (2003/2004), CRC Press, 2004
- ↑ « Bleu de bromothymol » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Une question sur le forum de Futura-Sciences
Voir aussi
Lien externe
- Portail de la chimie
Catégories : Composé du brome | Indicateur de pH | Ester sulfonique
Wikimedia Foundation. 2010.



