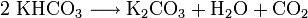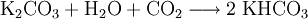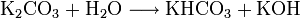- Bicarbonate de potasium
-
Bicarbonate de potassium
Bicarbonate de potassium Général Synonymes hydrogénocarbonate de potassium No CAS No EINECS No E E501(ii) SMILES InChI Apparence cristaux incolores transparents,
poudre ou granulés blancsPropriétés chimiques Formule brute KHCO3 Masse molaire 100,1151 g∙mol-1
C 12 %, H 1,01 %, K 39,05 %, O 47,94 %,Propriétés physiques T° fusion 100 à 200 °C (décomposition) Solubilité 32,2 g/100 ml dans l'eau (20 °C)
Insoluble dans l'alcoolMasse volumique 2,17 g/cm³ Précautions Peau Légèrement irritant
Laver avec de l’eau et du savonYeux Légèrement irritant
Laver à l’eau pendant 15 mnÉcotoxicologie DL50 >2000 mg/kg rats, oral Unités du SI & CNTP, sauf indication contraire. Le bicarbonate de potassium (aussi connu sous le nom d'hydrogénocarbonate de potassium), est un sel basique incolore et inodore.
Sommaire
Propriétés
Il se décompose entre 100 °C et 120 °C pour donner du carbonate de potassium, de l'eau et du dioxyde de carbone.
Il est considéré comme inoffensif pour la santé.
Fabrication
Il est fabriqué en faisant réagir du carbonate de potassium, de l'eau et du dioxyde de carbone :
On peut aussi le fabriquer à partir de carbonate de potassium et d'eau :
Utilisations
- Source de dioxyde de carbone
-
- Extincteurs : il est deux fois plus efficace que le bicarbonate de sodium. Utilisé pour les feux de classes B et C, dans le secteur de l’automobile.
- Levure chimique : il se décompose sous l'effet de la température.
- Gazéification des eaux gazeuses. Le CO2 est libéré grâce à de l'acide citrique.
- Comprimés effervescents : ils se désagrègent dans un verre d'eau
- Régulateur de pH
-
- Pour neutraliser les sols acides
- Régulateur alimentaire de pH
- Œnologie : se combine avec l'acide tartrique pour donner des sels insolubles. 1 g/l de KHCO3 fait chuter l'acidité de 0,49 g/lH2SO4
- Antiacide (Digestive biscuit)
Notes et références
- Portail de la chimie
Catégories : Composé du potassium | Carbonate | Produit chimique domestique | Régulateur alimentaire de pH | Agent de levuration
Wikimedia Foundation. 2010.