- Réaction de Bucherer-Bergs
-
La réaction de Bucherer-Bergs est une réaction en chimique organique entre un composé carbonylé (aldéhyde ou cétone) ou une cyanohydrine, le carbonate d'ammonium et le cyanure de potassium formant une hydantoïne[1],[2],[3],[4] :
Elle ne doit pas être confondue avec la réaction de Bucherer (ou réaction de Bucherer-Lepetit) qui transforme un naphtol en naphtylamine, ces deux réactions étant nommées d'après leur découvreur, le chimiste allemand Hans Theodor Bucherer.
Sommaire
Historique
Des réactions similaires à la réaction de Bucherer-Bergs sont observées la première fois en 1905 et 1914 par Ciamician et Silber, qui obtiennent la 5,5-diméthylhydantoïne à partir d'un mélange d'acétone et de cyanure d'hydrogène exposé au soleil pendant cinq à sept mois. En 1929, Bergs dépose un brevet décrivant la synthèse la synthèse de nombreuses hydantoïnes 5-substituées. Bucherer améliore la méthode de Bergs en découvrant qu'il était possible d'utiliser des températures et pressions plus basses. Bucherer et Steiner ont aussi découvert que les cyanohydrines réagissait aussi bien que les composés carbonylés pour produire des hydantoïnes. Plus tard, Bucherer et Lieb on découvert que l'alcool à 50% était un solvant efficace pour la réaction, les aldéhydes réagissant bien et les cétones donnant d'excellents rendements. En 1934, Bucherer et Steiner proposent un mécanisme pour la réaction, qui, bien que posant quelques problèmes était assez précis[4].
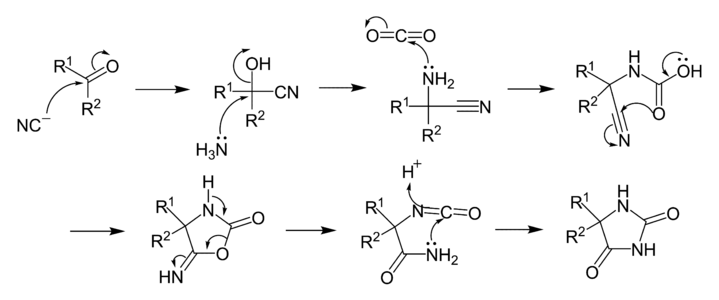
Mécanisme réactionnel
L'addition de KCN au composé carbonylé produit une cyanohydrine. Le mécanisme se poursuit par une SN2 par le NH3 pour former une aminonitrile. L'addition nucléophile de l'aminonitrile sur le CO2 forme un acide cyano-carbamique, qui par une réaction intra-moléculaire se cyclise en 5-imino-oxazolidin-2-one. La 5-imino-oxazolidin-2-one se réarrange ensuite en hydantoïne via un isomère isocyanate.
Amélioration
Par le passé, la réaction de Bucherer-Bergs avait des problèmes de polymérisation, de longs temps de réaction, et un work-up difficile. Une amélioration possible de la réaction de Bucherer-Bergs est l'utilisation d'ultrasons, permettant de d'accélérer entre autres la réaction. Des hydantoïnes 5,5-disubstitutées ont ainsi été préparées par réaction de Bucherer-Bergs sous ultrasons. Par comparaison effectuée sur la littérature, l'utilisation d'ultrasons permet de réduire la température de réaction, de raccourcir le temps de réaction, améliore le rendement et simplifie le work-up[5].
Variations
Utilisation de 2-méthylèneaziridine
Une des limites de la réaction de Bucherer-Bergs est l'absence de diversité dans les produits formés, puisque la seule variation possible est la structure du composé carbonylé initial.
Une possibilité pour accroître cette diversité est de combiner une réaction avec une 2-méthylenèaziridine et la réaction de Bucherer-Bergs dans une synthèse monotope :
Dans un premier temps, la 2-méthylèneaziridine (1) réagit avec un organomagnésien mixte et un dérivé halogéné R2-X, réaction catalysé par le Cu(I), provoquant l'ouverture du cycle de la 2-méthylèneaziridine et la formation d'une cétimine (2). La cétimine est mise en présence des réactifs de Bucherer-Bergs, formant une hydantoïne 5,5'- disubstituée (3). Cette réaction possède trois points de diversité chimique, la structure de l'aziridine initiale, celle de l'organomagnésien et celle du dérivé halogéné qui peuvent toutes être changées, permettant de synthétiser des hydantoïnes différentes[6] .
Synthèse de dithiohydantoïnes
Une variation de la réaction de Bucherer-Bergs est le traitement du composé carbonylé par le disulfure de carbone et le cynaure d'ammonium dans le méthanol afin de former un équivalent soufré de l'hydantoïne, la 2,4-dithiohydantoïne[7] :
De la même façon, une réaction entre une cétone, le monothiocarbamate d'ammonium et le cyanure de sodium permet d'obtenir une 4-thiohydantoïne 5,5-disubstitutée[8].
Applications
Les hydantoïnes formées par la réaction de Bucherer-Bergs peuvent avoir plusieurs applications :
- elles sont utiles en chimie des glucides ;
- elles sont des composés hétérocycliques importants qui ont des effets biologiques et sont notamment utilisés comme composés pharmaceutiques (par exemple la 5,5-diphénylhydantoïne, connue soue le nom de Dilantine)
- elles sont des précurseurs à des acides aminés artificiels.
Notes et références
- Erreur dans la syntaxe du modèle Article(de) H. T. Bucherer et H. T. Fischbeck, « », dans J. Prakt. Chem., vol. 140, 1934, p. 69 (ISSN 0941-1216)
- Erreur dans la syntaxe du modèle Article(de) H. T. Bucherer et W. Steiner, « », dans J. Prakt. Chem., vol. 140, 1934, p. 291 (ISSN 0941-1216)
- Bergs, H. Ger. pat. 566,094 (1929).
- (en) E. Ware, « The Chemistry of the Hydantoins », dans Chem. Rev., vol. 46, no 3, 1950, p. 403-470 (ISSN 0009-2665) [lien DOI]
- (en) J. Li, L. Li, T. Li, H. Li et J. Liu, « An efficient and convenient procedure for the synthesis of 5,5-disubstituted hydantoins under ultrasound », dans Ultrason. Sonochem., vol. 3, no 2, juillet 1996, p. S141-S143 (ISSN 1350-4177) [lien DOI]
- (en) C. Montagne, J. J. Shiers et M. Shipman, « Rapid generation of molecular complexity using ‘sequenced’ multi-component reactions: one-pot synthesis of 5,5′-disubstituted hydantoins from methyleneaziridines », dans Tetrahedron Lett., vol. 47, no 52, 25 décembre 2006, p. 9207-9209 (ISSN 0040-4039) [lien DOI]
- (en) H. C. Carrington, « Thiohydantoins. Part I. Preparation of 5:5-disubstituted 2:4-dithiohydantoins from the corresponding ketones », dans J. Chem. Soc., 1947, p. 681-683 [lien DOI]
- (en) H. C. Carrington, C. H. Vasey et W. S. Waring, « Thiohydantoins. Part V. A new synthesis of 5:5-disubstituted4-thiohydantoins », dans J. Chem. Soc., 1959, p. 396-397 [lien DOI]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Bucherer–Bergs reaction » (voir la liste des auteurs)
Voir aussi
- Synthèse d'hydantoïne d'Urech
- Synthèse de Strecker
Catégories :- Réaction formant une liaison carbone-carbone
- Réaction de condensation
- Réaction formant un hétérocycle
Wikimedia Foundation. 2010.