- Synthèse de Strecker
-
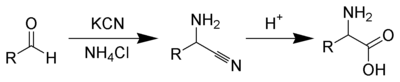
La synthèse de Strecker , nommée d'après Adolph Strecker qui l'a découverte et publiée pour la première fois en 1850, est une série de réactions chimiques permetannt la synthèse d'un acide aminé à partir d'un aldéhyde (ou d'une cétone)[1],[2],[3]. L'aldéhyde est condensé avec du chlorure d'ammonium en présence de cyanure de potassium pour former un α-aminonitrile, qui est ensuite hydrolysé pour donner l'acide aminé désiré[4],[5].
Si l'utilisation de sels d'ammonium donne des acides aminés non substitués, celui d'une amine primaire ou secondaire ammonium fonctionne aussi et donne des acides aminés substitués. De même, l'utilisation de cétones à la place d'aldéhydes donne des acides aminés α,α-disubstitués[6].
La synthèse originale d'Adolph Strecker de 1850 donne un mélange racémique d'α-aminonitriles, mais de récentes procédure utilisant des auxiliaires asymétriques[7] ou des catalyseurs asymétriques[8],[9] ont été développés et permettent d'obtenir un seul isomère[10].
Sommaire
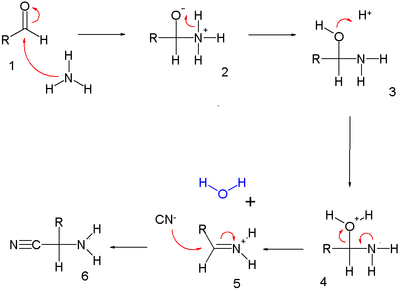
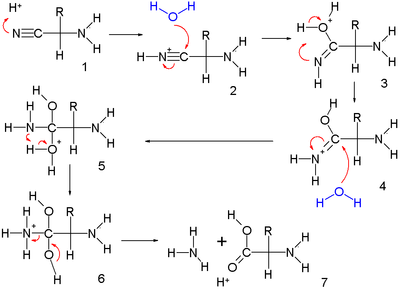
Mécanisme réactionnel
Le mécanisme réactionnel dec ette réaction est décrit ci-dessous:
Dans la première partie, l'aldéhyde (1.1) réagit avec l'ammoniac par addition nucléophile pour former un hémiaminal (1.3); ce dernier attire un proton pour former un ion iminium (1.5) par élimination d'eau. Une seconde addition nucléophile, cette fois-ci de l'ion cyanure, forme l'aminonitrile (1.6).
Dans la seconde partie, l'aminonitrile activé par un proton (2.1) subit une double addition nucléophile d'eau pour former l'intermédiaire (2.6). Celui-ci élimine de l'ammoniac et un proton pour donner le produit final (2.7).
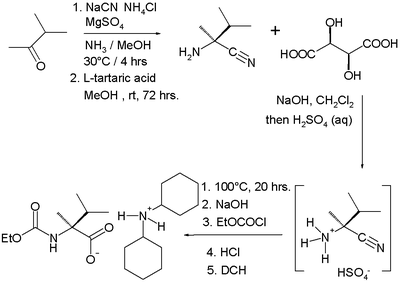
Utilisation
Un exemple d'utilisation actuelle de la synthèse de Strecker est la synthèse de masse d'un dérivé de L-valine en partant de la 3-méthylbutan-2-one[11] :
Le produit de la réaction initiale entre la 3-méthylbutan-2-one, le cyanure de sodium et l'ammoniac est resolu par application d'acide L-tartrique. L'acide aminé final est isolé comme sel d'acide par la dicyclohexylamine.
Notes et références
- Strecker, A., « Ueber die künstliche Bildung der Milchsäure und einen neuen, dem Glycocoll homologen Körper », dans Annalen der Chemie und Pharmazie, vol. 75, no 1, 1850, p. 27–45 [lien DOI]
- Strecker, A., « Ueber einen neuen aus Aldehyd - Ammoniak und Blausäure entstehenden Körper (p ) », dans Annalen der Chemie und Pharmazie, vol. 91, no 3, 1854, p. 349–351 [lien DOI]
- Shibasaki, M.; Kanai, M.; Mita, K. Org. React. 2008, 70, 1. (doi:10.1002/0471264180.or070.01)
- Kendall, E. C.; McKenzie, B. F. Organic Syntheses, Coll. Vol. 1, p.21 (1941); Vol. 9, p.4 (1929). (Article)
- Clarke, H. T.; Bean, H. J. Organic Syntheses, Coll. Vol. 2, p.29 (1943); Vol. 11, p.4 (1931). (Article)
- Masumoto, S.; Usuda, H.; Suzuki, M.; Kanai, M.; Shibasaki, M. J. Am. Chem. Soc. 2003, 125(19), 5634-5635. (DOI:10.1021/ja034980+)
- Davis, F. A. et al. Tetrahedron Lett. 1994, 35, 9351.
- Ishitani, H.; Komiyama, S.; Hasegawa, Y.; Kobayashi, S. J. Am. Chem. Soc. 2000, 122(5), 762-766. (DOI:10.1021/ja9935207)
- Huang, J.; Corey, E. J. Org. Lett. 2004, 6(26), 5027-5029. (DOI:10.1021/ol047698w)
- Duthaler, R. O. Tetrahedron 1994, 50, 1539-1650. (Review, DOI:10.1016/S0040-4020(01)80840-1)
- A Concise Synthesis of (S)-N-Ethoxycarbonyl--methylvaline Jeffrey T. Kuethe, Donald R. Gauthier, Jr., Gregory L. Beutner, and Nobuyoshi Yasuda J. Org. Chem., 72 (19), 7469 -7472, 2007. DOI:10.1021/jo7012862
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Strecker amino acid synthesis » (voir la liste des auteurs)
Voir aussi
Wikimedia Foundation. 2010.