- Isotopes de l'hydrogène
-
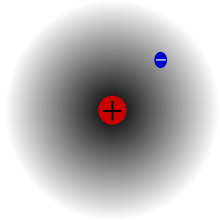 Le protium, l'isotope le pus commun de hydrogène, constitué d'un proton et d'un électron. Cas unique, c'est le seul isotope stable sans neutron.
Le protium, l'isotope le pus commun de hydrogène, constitué d'un proton et d'un électron. Cas unique, c'est le seul isotope stable sans neutron.
L'hydrogène (H) (masse atomique standard: 1,00782504(7) u) possède trois isotopes naturels, parfois notés 1H, 2H, and 3H. Les autres, particulièrement instables,(4H to 7H) ont été synthétisés en laboratoire mais jamais observés dans la nature[1],[2]
L'hydrogène est le seul élément ayant des noms différents pour ses différents isotopes, encore en usage de nos jours. L'isotope 2H (ou H-2) est appelé deutérium et l'isotope 3H (ou H-3) est appelé tritium, et les symboles D et T (au lieu de 2H and 3H) sont parfois utilisés pour les désigner. L'IUPAC, si elle en reconnait l'usage, ne le recommande cependant pas. L'isotope le plus commun de l'hydrogène, sans neutron, est parfois appelé « protium ». Au cours des premières études sur la radioactivité, on donna aussi des noms aux isotopes lourds de l'hydrogène, mais ces noms ne son plus en usage de nos jours.
Sommaire
Hydrogène 1 (protium)
1H est l’isotope le plus commun de l’hydrogène, avec une abondance de 99,98%. Comme son noyau est constitué d'un seul proton, il est parfois, et même plutôt rarement, appelé « protium ». En revanche l'ion oxonium H+ obtenu par la perte de l'unique électron de sup>1H est donc formellement constitué uniquement d'un proton est très couramment appelé « proton ».
Hydrogène 2 (deutérium)
2H, l'autre isotope stable de l'hydrogène, connu sous le nom de deutérium possède un noyau constitué d'un proton et d'un neutron. L'abondance atomique sur Terre du deutérium est comprise entre 0,0026 et 0,0184%, le nombre le plus bas correspondant au nombre trouvé dans le dihydrogène gazeux, le plus élevé dans un environnement enrichi (0,015% ou 150 ppm) comme l'eau de mer. Le deutérium n'est pas radioactif et ne représente pas un danger significatif en termes de toxicité. L'eau enrichie en molécules contenant du deutérium à la place d'atomes « normaux » d'hydrogène est appelée eau lourde. Le deutérium et ses composés sont utilisés comme marqueurs non-radioactifs dans des expériences de chimie et comme solvants pour la spectroscopie RMN du proton. L'eau lourde est elle utilisé comme modérateur de neutrons et liquide de refroidissement dans les réacteurs nucléaires. Le deutérium est aussi un possible combustible dans le cadre de la fusion nucléaire.
Hydrogène 3 (tritium)
3H connu sous le nom de tritium possède un noyau constitué d'un proton et de deux neutrons. C'est un élément radioactif se désintègre en hélium-3 par désintégration β- avec un demi-vie de 12,32 ans[3]. De petites quantités de tritium sont naturellement présente à cause de l'interaction entre les rayons cosmiques et les gaz atmosphériques. Du tritium a aussi été relâché lors d'essais d'armes nucléaires. Le tritium est utilisé dans des armes thermonucléaires, comme traceurs en géologie isotopique et dans certains dispositifs d'éclairage auto-alimentés.
La méthode la plus commune pour produire du tritium consiste à bombarder un isotope naturel du lithium, le lithium-6, avec des neutrons dans une réacteur nucléaire.
Le tritium était autrefois utilisé couramment comme marqueur en chimie et en biologie (mais son usage est devenu moins courant). La fusion nucléaire D-T utilise le tritium comme réactif principal avec du deutérium, libérant de l'énergie par la perte de masse quand les deux noyaux fusionnent à très haute température.
Hydrogène 4 (quadrium)
4H parfois appelé quadrium a possède un noyau constitué d'un proton et de trois neutrons. C'est un isotope de l'hydrogène hautement instable qui a été synthétisé en laboratoire en bombardant du tritium avec des noyaux rapides de deutérium[4]. dans cette expérience, le noyau de tritium capture un neutron du noyau rapide de deutérium. La présence d'hydrogène-4 a été déduite par la détection de l'émission de protons. Sa masse atomique est de 4,02781 ± 0,00011[5]. Il se dégsintègre par émission de neutron avec une demi-vie de (1,39 ± 0,10) × 10−22 secondes[6].
Hydrogène 4.1 (hélium muonique)
L'hélium muonique a été crée en substituant un électron de le hélium-4 par un muon, le muon orbitant plus près du noyau que l'électron. L'hélium muonique peut ainsi être vu comme un isotope de l'hydrogène dont le noyau est constitué de deux neutrons, deux protons et un muon, avec un seul électron orbitant autour du noyau. L'hydrogène 4.1 peut se lier avec d'autres atomes, et agit donc plus comme un atome d'hydrogène qu'un atome d'hélium, inerte[7].
Hydrogène 5
5H est un isotope hautement instable de l'hydrogène. Son noyau est constitué d'un proton et de quatre neutrons. Il a été synthétisé en laboratoire en bombardant du tritium par des noyaux rapides de tritium[4],[8]. Dans cette expérience, un noyau de tritium capture deux neutrons d'un autre noyau et devient donc un noyau à quatre neutrons. Le proton restant peut être détecté, prouvant par déduction l’existence d'hydrogène-5. Il se désintègre par double émission de neutron et sa demi-vie est d'au moins 9,1 × 10−22 secondes[6].
Hydrogène 6
6H est un isotope hautement instable de l'hydrogène. Son noyau est constitué d'un proton et de cinq neutrons. Il se désintègre par triple émission de neutron et sa demi-vie est de 2.90×10−22 secondes[6]
Hydrogène 7
7H est un isotope de l'hydrogène dont le noyau est constitué d'un proton et de six neutrons. Il a été synthétisé pour la première fois en 2003 par un groupe de scientifiques Russes, Japonais et Français au RIKEN, en bombardant de l'hydrogène avec des atomes d'hélium-8. Par cette réaction, les six neutrons de l'hélium-8 sont donnés au noyau d'hydrogène. Deux protons restant protons furent détecté par le « RIKEN telescope », un dispositif constitué de plusieurs couches de senseurs positionné en tre la cible et le rayon RI du cyclotron[2].
Table des isotopes
Symbole
de l’isotopeZ (p) N (n) masse isotopique (u) demi-vie mode(s) de
désintégration[9]isotope(s)-fils[n 1] spin nucléaire composition isotopique
représentative
(fraction molaire)gamme de
variations naturelles
(fraction molaire)1H 1 0 1,00782503207(10) Stable[n 2],[n 3] 1⁄2+ 0,999885(70) 0,999816–0,999974 2H[n 4] 1 1 2,0141017778(4) Stable 1+ 0,000115(70)[n 5] 0,000026–0,000184 3H[n 6] 1 2 3.0160492777(25) 12,32(2) an β- 4He 1⁄2+ Trace[n 7] 4H 1 3 4,02781(11) 1,39(10)×10-22 s
[4,6(9) MeV]n 3H 2− 5H 1 4 5,03531(11) >9,1×10-22 s ? n 4H (1⁄2+) 6H 1 5 6,04494(28) 2,90(70)×10-22 s
[1,6(4) MeV]3n 3H 2−# 4n 2H 7H 1 6 7,05275(108)# 2,3(6)×10-23 s#
[20(5) MeV]#1/2+# - Isotopes stables en gras
- Plus grande que 6,6.103 années. Voir désintégration du proton.
- 1H et 3He sont les seuls isotopes stables avec plus de protons que de neutrons
- Produit pendant la nucléosynthèse primordiale
- L'hydrogène en bouteille à une abondance en 2H plus basse que 3,2×10-5 (fraction molaire).
- Produit pendant la nucléosynthèse primordiale, mais plus primordial, car tous les atomes ainsi produits ont été désintégré en 3He
- Cosmogénique
Remarques
- Les valeurs marquées # ne sont pas purement dérivées des données expérimentales, mais aussi au moins en partie à partir des tendances systématiques. Les spins avec des arguments d'affectation faibles sont entre parenthèses.
- Les incertitudes sont donnée de façon concise entre parenthèse après la décimale correspondante. Les valeurs d'incertitude dénotent un écart-type, à l'exception de la composition isotopique et de la masse atomique standard de l'IUPAC qui utilisent incertitudes élargies.
Notes et références
- Masse des isotopes depuis :
- G. Audi, A. H. Wapstra, C. Thibault, J. Blachot and O. Bersillon, « The NUBASE evaluation of nuclear and decay properties », dans Nuclear Physics A, vol. 729, 2003, p. 3–128 [texte intégral, lien DOI]
- Compositions isotopiques et masses atomiques standards :
- J. R. de Laeter, J. K. Böhlke, P. De Bièvre, H. Hidaka, H. S. Peiser, K. J. R. Rosman and P. D. P. Taylor, « Atomic weights of the elements. Review 2000 (IUPAC Technical Report) », dans Pure and Applied Chemistry, vol. 75, no 6, 2003, p. 683–800 [texte intégral, lien DOI]
- M. E. Wieser, « Atomic weights of the elements 2005 (IUPAC Technical Report) », dans Pure and Applied Chemistry, vol. 78, no 11, 2006, p. 2051–2066 [texte intégral, lien DOI]
- Demi-vie, spin et données sur les isomères sélectionnés depuis les source suivantes :
- G. Audi, A. H. Wapstra, C. Thibault, J. Blachot and O. Bersillon, « The NUBASE evaluation of nuclear and decay properties », dans Nuclear Physics A, vol. 729, 2003, p. 3–128 [texte intégral, lien DOI]
- National Nuclear Data Center, « NuDat 2.1 database », Brookhaven National Laboratory. Consulté le September 2005
- (en) N. E. Holden, CRC Handbook of Chemistry and Physics, CRC Press, 2004 (ISBN 978-0849304859), « Table of the Isotopes », p. Section 11
- Y. B. Gurov et al., « Spectroscopy of superheavy hydrogen isotopes in stopped-pion absorption by nuclei », dans Physics of Atomic Nuclei, vol. 68, no 3, 2004, p. 491–497 [lien DOI]
- A. A. Korsheninnikov et al., « Experimental Evidence for the Existence of 7H and for a Specific Structure of 8He », dans Physical Review Letters, vol. 90, no 8, 2003, p. 082501 [lien DOI]
- (en) G. L. Miessler, D. A. Tarr, Inorganic Chemistry, Pearson Prentice Hall, 2004
- G. M. Ter-Akopian et al., « AIP Conference Proceedings », dans AIP Conference Proceedings, vol. 610, 2002, p. 920 [lien DOI]
- The 2003 Atomic Mass Evaluation, Atomic Mass Data Center. Consulté le 2008-11-15
- G. Audi, A. H. Wapstra, C. Thibault, J. Blachot and O. Bersillon, « The NUBASE evaluation of nuclear and decay properties », dans Nuclear Physics A, vol. 729, 2003, p. 3–128 [texte intégral, lien DOI]
- D. G. Fleming, « Kinetic Isotope Effects for the Reactions of Muonic Helium and Muonium with H2 », dans Science, vol. 331, no 6016, 28 Jan 2011, p. 448–450 [texte intégral, lien PMID, lien DOI]
- A. A. Korsheninnikov et al., « Superheavy Hydrogen 5H », dans Physical Review Letters, vol. 87, no 9, 2001, p. 92501 [lien DOI]
- http://www.nucleonica.net/unc.aspx
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Isotopes of hydrogen » (voir la liste des auteurs)
Voir aussi
Wikimedia Foundation. 2010.
