- Oxyde de cuivre(II)
-
Oxyde cuivrique 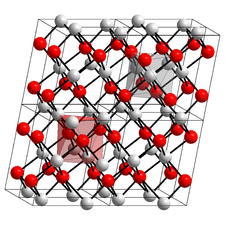
__ Cu2+ __ O2-
Maille cristalline de l'oxyde cuivrique.Général Nom IUPAC Oxyde de cuivre(II) No CAS No EINECS No RTECS PubChem SMILES InChI Apparence poudre noire Propriétés chimiques Formule brute CuO [Isomères] Masse molaire[1] 79,545 ± 0,003 g·mol-1
Cu 79,89 %, O 20,11 %,Propriétés physiques T° fusion 1 326 °C [2] T° ébullition 2 000 °C Masse volumique 6,315 g·cm-3 Propriétés électroniques Bande interdite 1,2 eV constante diélectrique 18,1 à 15°C Propriétés optiques Indice de réfraction  2,63
2,63Précautions Directive 67/548/EEC[3] 
Xn
NPhrases R : 22, 50/53, Phrases S : 22, 61, Transport[3] 90 3077 SGH[3] 

AttentionUnités du SI & CNTP, sauf indication contraire. L’oxyde de cuivre(II) ou, oxyde cuivrique, est un composé chimique de formule CuO. Il s'agit d'un solide noir à structure ionique fondant vers 1 200 °C en dégageant un peu d'oxygène. Le cuivre y est à son état d'oxydation +2. Sa forme minérale est la ténorite.
Sommaire
Propriétés chimiques
On peut former de l'oxyde cuivrique en chauffant du cuivre à l'air libre, mais il se forme alors également de l'oxyde cuivreux Cu2O :
L'oxyde cuivrique peut être obtenu avec un meilleur degré de pureté en chauffant du nitrate de cuivre(II) Cu(NO3)2, de l'hydroxyde de cuivre(II) Cu(OH)2 ou du carbonate de cuivre(II) CuCO3 :
- 2 Cu(NO3)2 → 2 CuO + 4 NO2 + O2.
- basique et réagit avec les acides minéraux tels que l'acide chlorhydrique HCl, l'acide sulfurique H2SO4 ou l'acide nitrique HNO3 en donnant le sel de cuivre(II) correspondant :
Il réagit avec les bases concentrées pour former les sels de cuprates correspondants :
- 2 XOH + CuO + H2O → X2[Cu(OH)4].
Il peut également être réduit en cuivre métallique à l'aide d'hydrogène H2 ou de monoxyde de carbone CO :
Une méthode de préparation de l'oxyde cuivrique en laboratoire consiste à électrolyser une solution aqueuse de bicarbonate de sodium NaHCO3 avec une anode en cuivre sous faible différence de potentiel : il suffit alors de chauffer le mélange d'hydroxyde de cuivre(II) Cu(OH)2 et de carbonate de cuivre(II) CuCO3 obtenu.
Applications
L'oxyde cuivrique est utilisé comme pigment pour produire des lumières bleues en pyrotechnie.
Il intervient dans la production de solutions de réactif de Schweitzer [Cu(NH3)4(H2O)2](OH)2, utilisé notamment dans le fabrication de la viscose.
Il trouve des applications comme matériau semiconducteur de type p en raison de sa faible largeur de bande interdite (1,2 eV).
Il est également utilisé comme abrasif en optique, et dans la fabrication de certaines piles électriques.
Il est parfois utilisé à la place de l'oxyde de fer dans la thermite pour en faire un explosif de faible puissance plutôt qu'un matériau incendiaire.
Notes et références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- « COPPER(II) OXIDE » dans la base de données Hazardous Substances Data Bank, consulté le 5 août 2011
- Entrée de « Copper(II) oxide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 26 mars 2011 (JavaScript nécessaire)
Voir aussi
Articles connexes
- Oxyde cuivreux Cu2O
Catégories :- Composé du cuivre
- Produit chimique nocif
- Produit chimique dangereux pour l'environnement
- Oxyde
- Matériau semi-conducteur
Wikimedia Foundation. 2010.


