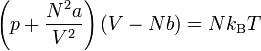- Équation d’état
-
Équation d'état
En thermodynamique, une équation d'état d'un système à l'équilibre thermodynamique est une relation entre différents paramètres physiques (appelés variables d'état) qui déterminent son état. Il peut s'agir par exemple d'une relation entre sa température, sa pression et son volume. À partir de l'équation d'état caractéristique d'un système physique, il est possible de déterminer la totalité des quantités thermodynamiques décrivant ce système et par suite de prédire ses propriétés.
Les équations d'état sont généralement restreintes à un type de comportement ou de phénomènes physiques donnés. Un même corps peut donc avoir plusieurs équations d'état, concernant par exemple son état magnétique ou son état thermodynamique.
Pour qu'un corps puisse être caractérisé par une équation d'état à un instant donné, il faut que l'état de ce corps dépendent uniquement des valeurs prises par les paramètres à cet instant. Les corps présentant un phénomène d'hystérésis ne peuvent donc pas être caractérisés par une équation d'état.
Sommaire
Exemple d'un fluide
Comme exemple le plus simple, considérons un fluide (gaz ou liquide) en équilibre thermodynamique. On utilise couramment quatre variables d'état :
- sa pression P,
- sa température T,
- son volume V ,
- le nombre de particules N.
Une telle relation est insuffisante pour caractériser un fluide. Il faut de plus une indication d'ordre énergétique.
La thermodynamique indique que la variable caractéristique est l'énergie interne U fonction de l'entropie S, du volume V et du nombre de particules N. Une fois la relation entre ces quatre variables connue, il est toujours possible de calculer les dérivées partielles de l'énergie interne par rapport à l'entropie et au volume pour en déduire la température et la pression, ce qui permet de retrouver, au moins localement, l'équation d'état en termes de P, V, T et N. Via la méthode de changement des variables due à Legendre, on peut montrer que le jeu de 4 variables caractéristiques le plus commode est : l'enthalpie libre G ( :=U+PV-TS) fonction de P et T aisément mesurables : G = N.f(P,T). Alors comme la différentielle dG vaut dG = V.dP -S.dT ( +f.dN), il apparaît que l'on obtient directement
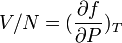 pour équation d'état : raison pour laquelle les tables thermodynamiques donnent souvent G(P,T)/N.
pour équation d'état : raison pour laquelle les tables thermodynamiques donnent souvent G(P,T)/N.À la limite des grands N (V/N fini), qui est le cadre de la thermodynamique, on obtient donc 1 relation entre les trois quantités V/N , P et T appelée ordinairement équation d'état.
Quelques exemples d'équations d'état
Gaz parfait à l'équilibre thermodynamique global (ETG)
L'équation d'état d'un gaz parfait à l'E.T.G s'écrit :
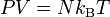 ,
,kB étant la constante de Boltzmann. L'équation peut bien sûr être exprimée en termes de la densité particulaire n :
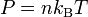 .
.On trouve également dans la littérature l'expression :
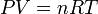 .
.Cette fois ci n correspond au nombre de moles du gaz considéré. La constante R est la constante universelle des gaz parfaits et vaut 8,314472 m2.kg.s-2.K-1.mol-1. La relation entre R et kb est simplement R = kbNa.
Gaz parfait à l'équilibre thermodynamique local (ETL)
En pratique rien n'assure que la matière considérée a une pression, une température et une densité uniformes dans tout le volume du gaz ; on parle alors d'état d'équilibre thermodynamique local (s'il a eu le temps de se réaliser, sinon on dit que le phénomène est hors ETL). Il est donc souvent pertinent d'écrire l'équation d'état en un point x donné de l'espace :
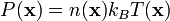 .
.
Polytrope
Un polytrope est défini par le fait que son équation d'état ne dépend pas explicitement de sa température, souvent par relation adiabatique. L'équation d'état d'un polytrope s'écrit
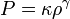 ,
,
κ étant une constante, ainsi que γ, qui est appelé indice adiabatique.
Équation d'état de van der Waals
L'équation d'état des gaz parfait ne permet pas de rendre compte de certaines propriétés cruciales, en particulier le fait qu'un fluide puisse exister à l'état liquide et à l'état gazeux. Des équations d'état plus sophistiquées permettent de rendre compte de cette possibilité d'exister dans plusieurs états. La plus simple équation d'état le permettant et appelée équation d'état de van der Waals. Elle s'écrit :
Cette équation permet d'expliquer l'existence de deux état différents pour le fluide, ainsi que le fait qu'au delà d'une certaine température et d'une certain pression, il n'est plus possible de distinguer un liquide d'un gaz.
Le terme homogène à un volume Nb correspond au volume intrinsèque occupé par les N molécules du fluide considéré (au sens large). Le volume moléculaire propre b où covolume dépend donc de la nature du fluide considéré.
Le terme
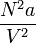 correspond à une pression. Ce terme de pression dit de cohésion peut-être vu comme la résultante des forces d'interaction par unité de surface entre les molécules du fluide (Il peut s'agir par exemple d'interaction dipolaires). Tout comme le paramètre "b", "a", dépend de la nature du fluide considéré. Ces deux paramètres peuvent, dans le cas général, être des fonction plus ou moins compliquées des autres grandeurs thermodynamiques.
correspond à une pression. Ce terme de pression dit de cohésion peut-être vu comme la résultante des forces d'interaction par unité de surface entre les molécules du fluide (Il peut s'agir par exemple d'interaction dipolaires). Tout comme le paramètre "b", "a", dépend de la nature du fluide considéré. Ces deux paramètres peuvent, dans le cas général, être des fonction plus ou moins compliquées des autres grandeurs thermodynamiques.Gaz de photons
Si l'on considère un gaz de photons à l'équilibre thermodynamique, ceux-ci obéissent à une équation d'état très simple, à savoir :
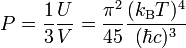 ,
,
la densité de photons étant elle-même fixée par la relation
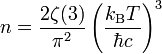 ,
,
où
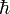 est la constante de Planck réduite, c la vitesse de la lumière et ζ la fonction zêta de Riemann (ζ(3) valant approximativement 1,202).
est la constante de Planck réduite, c la vitesse de la lumière et ζ la fonction zêta de Riemann (ζ(3) valant approximativement 1,202).Équation d'état du paramagnétisme
Dans un domaine complètement différent, celui du paramagnétisme, il est possible de décrire les variables d'état d'un cristal paramagnétique soumis à un champ magnétique extérieur. Cette fois, les variables d'état sont : outre le nombre de particules N, la température T, et le volume V, on a l'aimantation moyenne M, et l'intensité du champ magnétique. On montre que l'équation d'état s'écrit
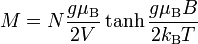 ,
,
où les quantité g et μB sont le facteur de Landé et le magnéton de Bohr.
Cette équation permet de comprendre le refroidissement par coupure de champ adiabatique ( très utilisée par Giauque , Nobel chimie 1949).
Autres
Dans le domaine de la physique des trous noirs, l'ensemble des paramètres macroscopiques qui décrivent un trou noir (masse, charge électrique, moment cinétique) permettent de déterminer sa surface (plus précisément la surface de son horizon). Cette relation présente des similarités extrêmement frappantes avec une équation d'état en thermodynamique, pourvu que l'on assimile la masse à l'énergie interne et la surface à l'entropie. Cette analogie a donné naissance à la thermodynamique des trous noirs.
Dans le domaine des hautes pressions en science de la terre ou en physique du solide, on utilise les équations d'état de Murnaghan ou Birch-Murnaghan.
Articles connexes
- Thermodynamique
- Fonction d'état
- Transition de phase
- Gaz de van der Waals
- Gaz de Dieterici
- Thermodynamique des trous noirs
- Portail de la physique
- Portail de la chimie
Catégories : Thermodynamique | Chimie générale | Thermochimie
Wikimedia Foundation. 2010.