- Bactériorhodopsine
-
001 Glu Ala Gln Ile Thr Gly Arg Pro Glu Trp 011 Ile Trp Leu Ala Leu Gly Thr Ala Leu Met 021 Gly Leu Gly Thr Leu Tyr Phe Leu Val Lys 031 Gly Met Gly Val Ser Asp Pro Asp Ala Lys 041 Lys Phe Tyr Ala Ile Thr Thr Leu Val Pro 051 Ala Ile Ala Phe Thr Met Tyr Leu Ser Met 061 Leu Leu Gly Tyr Gly Leu Thr Met Val Pro 071 Phe Gly Gly Glu Gln Asn Pro Ile Tyr Trp 081 Ala Arg Tyr Ala Asp Trp Leu Phe Thr Thr 091 Pro Leu Leu Leu Leu Asp Leu Ala Leu Leu 101 Val Asp Ala Asp Gln Gly Thr Ile Leu Ala 111 Leu Val Gly Ala Asx Gly Ile Met Ile Gly 121 Thr Gly Leu Val Gly Ala Leu Thr Lys Val 131 Tyr Ser Tyr Arg Phe Val Trp Trp Ala Ile 141 Ser Thr Ala Ala Met Leu Tyr Ile Leu Tyr 151 Val Leu Phe Phe Gly Phe Thr Ser Lys Ala 161 Glx Ser Met Arg Pro Glu Val Ala Ser Thr 171 Phe Lys Val Leu Arg Asn Val Thr Val Val 181 Leu Trp Ser Ala Tyr Pro Val Val Trp Leu 191 Ile Gly Ser Glu Gly Ala Gly Ile Val Pro 201 Leu Asn Ile Glu Thr Leu Leu Phe Met Val 211 Leu Asp Val Ser Ala Lys Val Gly Phe Gly 221 Leu Ile Leu Leu Arg Ser Arg Ala Ile Phe 231 Gly Glu Ala Glu Ala Pro Glu Pro Ser Ala 241 Gly Asp Gly Ala Ala Ala Thr Ser Séquence peptidique de la bactériorhodopsine[1]. La bactériorhodopsine est une petite protéine de 248 acides aminés qu'on trouve chez certaines archées, notamment les halobactéries, où elle fonctionne comme une pompe à protons utilisant l'énergie lumineuse pour générer un gradient de protons à travers la membrane cellulaire. Elle se présente sous forme d'un homotrimère à symétrie cylindrique, chacune des trois unités identiques ayant une structure en sept hélices α transmembranaires — structure dite opsine — emprisonnant un chromophore, ici une molécule de rétinal liée au résidu lysine 216 par une base de Schiff protonée.
On trouve cette protéine notamment dans la membrane pourpre de l'archée halophile Halobacterium salinarum.
Sommaire
Fonctionnement biologique
La molécule se comporte globalement comme une pompe à protons générant une différence de pH entre la zone extra-cellulaire et l'intérieur de la cellule, ce gradient de protons permettant à son tour de produire de l'ATP.
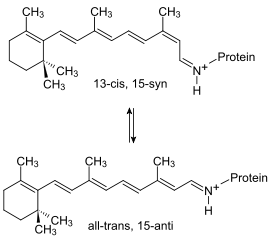
Le pompage des protons hors de la cellule est actionné par les changements conformationnels de la bactériorhodopsine induits par l'alternance entre la forme 13-cis, 15-syn excitée et la forme all-trans, 15-anti à l'état fondamental du rétinal :
Le mécanisme du pompage peut être résumé de la façon suivante :
- État L : l'excitation de la bactériorhodopsine par un photon — maximum d'absorption à 568 nm — déclenche directement le passage de la forme all-trans protonée à la forme 13-cis protonée du rétinal.
- État M : le rétinal 13-cis transfère le proton de sa base de Schiff au résidu aspartate 85.
- État N : le rétinal 13-cis reprotone sa base de Schiff à partir du résidu aspartate 96, ce dernier tirant son proton de l'intérieur de la cellule. Dans le même temps, le proton stationnant sur le résidu aspartate 85 est expulsé vers l'extérieur de la cellule en direction du résidu arginine 82 à travers un réseau de molécules d'eau maintenues ensemble par des liaisons hydrogène.
Le rétinal reprotoné retrouve sa configuration all-trans et la protéine, dont les charges électriques internes se sont rééquilibrées, reprend sa conformation initiale. Chacun de ces photocycles dure in vivo de 10 à 20 ms.
 La bactériorhodopsine, une mémoire de données opto-biologique.
La bactériorhodopsine, une mémoire de données opto-biologique.
Utilisation nano-informatique
La simplicité de la bactériorhodopsine en a fait un modèle pour l'étude de la bioénergétique et pour le transport membranaire. Elle intéresse aussi l'industrie du stockage de données, dans la mesure où elle pourrait servir d'unité de stockage extrêmement miniaturisée pilotable par des impulsions lumineuses (à raison d'un bit par molécule, un disque de 12 centimètres de diamètre pourrait contenir de 20 à 50 To). L'emploi de la bactériorhodopsine constitue l'une des premières applications de l'électronique moléculaire organique, une discipline émergente de la nano-informatique.
Notes et références
- (en) H. Gobind Khorana, Gerhard E. Gerber, Walter C. Herlihy, Christopher P. Gray, Robert J. Anderedd, Kayoro Nihei et Klaus Biemann, Amino acid sequence of bacteriorhodopsin, Proc. Natl. Acad. Sci. USA, Vol. 76, No. 10, pp. 5046-5050, Octobre 1979.
Voir aussi
Liens externes
- Thése de doctorat de l'École Polytechnique – 19 septembre 2005 « Polarisation ultrarapide et mouvements vibrationnels dans la bactériorhodopsine étudiés par spectroscopie cohérente d’émission infrarouge », par Anne Colonna.
Bibliographie
- Science magazine, 1997 - pages 277-1676
- Nature, 1999 - pages 401-822
- Nature, 2000 - pages 406-645
-
Wikimedia Foundation. 2010.