- Valinomycine
-
Valinomycine 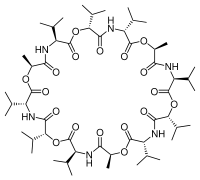
Général Nom IUPAC 2S,5R,8R,11S,14S,17R,20R,23S,26S,29R,32R,35S)-2,14,26-triméthyl-5,8,11,17,20,23,29,32,35-nona(propan-2-yl)-3,9,15,21,27,33-hexaoxa-6,12,18,24,30,36-hexazacyclohexatriacontane-1,4,7,10,13,16,19,22,25,28,31,34-dodécone No CAS No EINECS SMILES InChI Apparence solide blanc Propriétés chimiques Formule brute C54H90N6O18 Masse molaire[1] 1 111,3218 ± 0,0561 g·mol-1
C 58,36 %, H 8,16 %, N 7,56 %, O 25,91 %,Propriétés physiques T° fusion 190 °C [2] Solubilité peu soluble dans l'eau[2] Précautions Directive 67/548/EEC[2] 
T+Phrases R : 27/28, Phrases S : 28, 36/37, 45, Transport[2] 66/60 2811 Unités du SI & CNTP, sauf indication contraire. La valinomycine est un dodecadepsipeptide synthétisé par certaines espèces de streptomyces. Il entraîne la perméabilisation des membranes biologiques à l'ion potassium.
Elle fait partie d'un groupe d'ionophores naturellement neutres car elle n'a pas de charge résiduelle. Elle consiste en énantiomères de D- et L-valine (Val), D-acide hydroxyvalérique et L-acide lactique. Les structures sont liées en alternance par des liaisons ester et amide. La valinomycine est fortement sélective pour les ions potassium en priorité sur les ions sodium dans la membrane cellulaire[3]. Elle fonctionne comme transporteur spécifique et facilite le mouvement passif des ions potassium de part et d'autre de la membrane lipidique en suivant le gradient de potentiel électrochimique[4]. La constante de stabilité K pour le complexe potassium-valinomycine est de 106 mais uniquement de 10 dans le cas du complexe sodium-valinomycine[5]. Cette différence est importante dans le maintien de la sélectivité de la valinomycine pour le transport des ions potassium (et non des ions sodium) dans les systèmes biologiques.
Structure
La valinomycin est dodécadepsipeptide, c'est-à-dire qu'elle est composée de douze acides aminés et esters en alternance formant une molécule macrolytique. Les douze groupements carbonyle sont essentiels pour la capture d'ions métalliques, ainsi que pour la solubilisation dans les solvants polaires. Les groupes isopropyle et méthyle sont responsables de la solubilisation dans les solvants non polaires[6]. En plus de sa forme et de sa taille, cette dualité moléculaire est la raison principale de ses propriétés de liaison. Les ions K+ sont coordonnés sous forme octaédrique dans une géométrie bipyramidale carrée par six liaisons carbonyle de la valine. Dans cet espace de 1,33 angstrom, le rayon de 1,57 angstrom du Na+ ne loge pas, menant à une sélectivité 10 000 fois plus grande pour le potassium que pour le sodium. Dans un solvant polaire, la valinomycine expose principalement les groupements carbonyle, tandis que dans un solvant non polaire les groupes isopropyle sont principalement situés sur le côté extérieur de la molécule. Cette conformation change lorsque la valinomycine est liée à un ion potassium. La molécule est "barrée" en une conformation où les groupes isopropyles sont à l'extérieur. Cette configuration n'est pas réellement fixe car la taille de la molécule lui confère une grande flexibilité, mais l'ion potassium donne un certain degré de coordination à la macromolécule.
Applications
On a récemment rapporté que la valinomycin était l'agent le plus puissant contre le Syndrome Respiratoire Aigu Sévère causé par le coronavirus (SRAS-CoV) chez des cellules Vero E6 infectées.
La valinomycin agit en tant qu'agent isomorphe non métallique dans les électrodes à membrane sélective au potassium[7],[8].
Notes et références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Entrée de « Valinomycin » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 16 décembre 2009 (JavaScript nécessaire)
- Lars, Rose; Jenkins ATA,, « The effect of the ionophore valinomycin on biomimetic solid supported lipid DPPTE/EPC membranes », dans Bioelectrochem., vol. 70, no 2, 2007, p. 387–393 [lien PMID, lien DOI]
- Cammann K, « Ion-selective bulk membranes as models », dans Top. Curr. Chem., vol. 128, 1985, p. 219–258
- M.C. Rose, « Stability of sodium and potassium complexes of valinomycin », dans BBA, vol. 372, no 2, 1974, p. 426–435 [texte intégral, lien DOI]
- Thompson M and Krull UJ, « The electroanalytical response of the bilayer lipid membrane to valinomycin: membrane cholesterol content », dans Anal. Chim. Acta, vol. 141, 1982, p. 33–47 [lien DOI]
- Safiulina D, Veksler V, Zharkovsky A and Kaasik A, « Loss of mitochondrial membrane potential is associated with increase in mitochondrial volume: physiological role in neurones », dans J. Cell. Physiol., vol. 206, no 2, 2006, p. 347–353 [lien PMID, lien DOI]
- Potassium ionophore Bulletin
- Portail de la chimie
- Portail de la biologie cellulaire et moléculaire
- Portail de la biochimie
Wikimedia Foundation. 2010.

