- Système des ganglions de la base du primate
-
Le système des ganglions de la base correspond à un ensemble pair de noyaux interconnectés entre eux au sein du système nerveux. Ils sont principalement situés aux étages télencéphalique et diencéphalique. Ces noyaux comprennent :
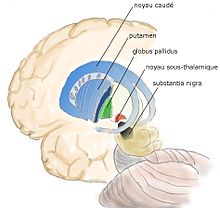
- le striatum dorsal : noyau caudé et putamen,
- le pallidum, composé du globus pallidus interne et externe, GPi, GPe
- le noyau sous-thalamique,
- la substance noire ou locus niger LN
tandis-que le striatum ventral comprendrait :
- le noyau accumbens septi et
- les tubercules olfactifs, en partie.
Ces noyaux sont globalement organisés en circuits parallèles réalisant des boucles cortico-striato-thalamo-corticales impliqués dans des fonctions motrices, affectives (système limbique) et cognitives.
Le pallidum et la substance noire participent à des voies descendantes vers les centres moteurs de la moelle épinière, grâce à des connexions avec l'habenula, la formation réticulée et les colliculi supérieurs.
Cet ensemble se rattache anciennement au système extrapyramidal.
L'atteinte de ce système peut entraîner des troubles tels que la maladie de Parkinson, l'hémiballisme, la chorée, des troubles obsessionnels et compulsifs, et peut être incriminé dans des atteintes psychiatriques comme la schizophrénie.
Certains neuroanatomistes (comme D. Hasboun[1]) utilisent l'ancien terme français de noyaux gris centraux avec la même valeur que "ganglions de la base".
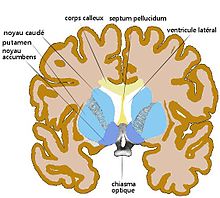
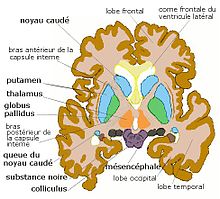
Striatum dorsal et ventral (n. accumbens),
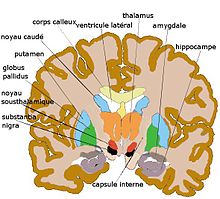
coupe coronale antérieure de cerveau humainStriatum, pallidum,
coupe coronale plus postérieureHistoire
La première identification anatomique de structures subcorticales[2] particulières à la « base » du cerveau a été effectuée par Willis en 1664. Pendant de nombreuses décades (Vieussens, 1614-1715), le terme de « corpus striatum » a été utilisé pour décrire des groupes d'éléments sous-corticaux étendus (mais flous), dont plusieurs (le thalamus, le noyau rouge entre autres) ont été découverts plus tard ne pas appartenir à un ensemble cohérent. A la même époque, le putamen et le noyau caudé n'étaient pas liés. Le putamen était associé au pallidum dans ce qui était appelé le « noyau lenticulaire » (voir Dejerine, 1906). Le travail fondamental des Vogts (1941) a simplifié la description en proposant de lier sous le seul terme de striatum, les éléments constitués des mêmes espèces neuronales, striatales. Le striatum unit ainsi le noyau caudé, le putamen et le fundus qui les lient ventralement.
Le striatum tient son nom de l'aspect strié créé par les « faisceaux » denses et radiés formés par les axones striato-pallidonigraux décrits par Kinnier Wilson (1912) comme des « pencils » arrangés « comme les rayons d'une roue ».
Le pallidum n'est nulle part un globe. Les Vogts ont proposé le recours à l'adjectif neutre de « pallidum » (lat. pallidus « de couleur jaune pâle »).
Pour l'autre cible, historiquement, le premier terme utilisé a été celui de locus niger (lieu noir) (Soemmering, 18 ). La substance noire, substantia nigra, terme usuel maintenant, n'est pas une substance. Les Vogt avaient proposé nigrum. Nigra peut décrire ce que l'on nomme communément en français « la noire ». Le lien anatomique du striatum avec ses cibles primaires, le pallidum et la noire a été repéré tôt. La similitude morphologique de ces cibles a été notée précocement (Mirto, 18 ). Leur regroupement en un ensemble bien caractérisable (l'ensemble pallidonigral) n'est toujours pas bien accepté ni compris, en dépit d'un solide ensemble d'arguments.
L'ensemble striato-pallidonigral forme le cœur du système des ganglions de la base. Le faisceau striato-pallidonigral passe à travers le pallidum (latéral puis médian), traverse la capsule interne en formant le « faisceau en peigne » (Kamsystem d'Edinger) pour atteindre la noire (locus niger, substantia nigra). Le faisceau a fait l'objet d'études approfondies de Fox[3] et ses collaborateurs.
D'autres éléments ont été plus tard, sur des arguments solides, associés au système des ganglions de la base. Le premier a été le « corps de Luys » (1865) ou noyau sous-thalamique(ou subthalamique) dont la lésion a été connue assez tôt produire un syndrome moteur particulier, l'hémiballisme. Plus récemment, d'autres régions cérébrales ont été rattachées au système: le complexe ou région centrale (complexe centre médian-parafasciculaire) (Percheron et al.[4] 1991) et le complexe pedonculopontin.
Circuits
Ils font partie de deux grandes boucles cortico-sous-corticales :
- une voie directe activatrice par désinhibition du thalamus
- une voie indirecte inhibitrice du thalamus
Leurs lésions entraînent des symptômes concernant la régulation du tonus et de la motricité[5]
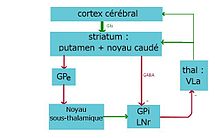
1. Circuit direct:
Cortex cérébral ⇒ striatum ⇒ pallidum interne/substance noire r ⇒ thalamus ⇒ cortex cérébral
2. Circuit indirect:
Cortex cérébral ⇒ striatum ⇒ pallidum externe ⇒ noyau sousthalamique ⇒ pallidum /substance noire r ⇒ thalamus ⇒ cortex cérébral
Définition et constitution
Le système des ganglions de la base, identifié tardivement, a présenté des problèmes y compris de nomenclature. Le terme de « base » vient du fait que la plupart des éléments sont situés à la base de l'hémisphère (mais le « noyau basal de Meynert » par exemple n'en fait pas partie). Le terme de ganglion n'a jamais été adéquat pour un élément du système nerveux central. Les Terminologia anatomica (1998), seule référence internationale en matière de nomenclature, ont retenu le nom de « nuclei basales », qui n'est utilisé par personne.
L'International Basal Ganglia Society (IBAGS) n'a jamais statué formellement mais considère de manière pragmatique comme ganglion de la base, le striatum (noyau caudé et putamen), le pallidum (interne et externe), la substantia nigra (pars compacta et pars reticulata) et le noyau sous-thalamique + le noyau accumbens septi et les tubercules olfactifs formant, tous deux, le striatum ventral. Y sont parfois associés les noyaux thalamiques intra-laminaires (centro-median et parafasciculaire) (Percheron et al. 1991, Parent and Parent, 2005) et le noyau pedunculopontin (Mena-Segovia et al. 2004).
Connexion corticostriée
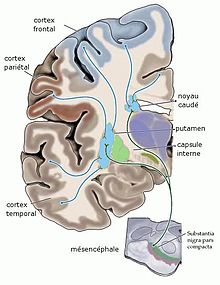 Organisation des afférences reçues par le striatum ; coupe coronale idéalisée du cerveau humain, d'après Purves D. et al Neurosciences[6], la connexion corticostriée est glutamatergique, la connexion nigrostriée est dopaminergique
Organisation des afférences reçues par le striatum ; coupe coronale idéalisée du cerveau humain, d'après Purves D. et al Neurosciences[6], la connexion corticostriée est glutamatergique, la connexion nigrostriée est dopaminergique
Le système des ganglions de la base peut, pour une part importante, mais qui ne peut plus être la seule, être vu comme une sortie majeure du cortex, d'une taille équivalente, chez le primate, à celle du système corticopontin qui ouvre la voie au système cérébelleux. La connexion corticostriée[N 1] (du cortex vers le striatum), représente une portion importante de l'ensemble de sorties corticales. Presque toutes les parties du cortex, sauf les cortex sensoriels « primaires » (visuel, auditif, olfactif), envoient des axones au striatum. L'origine de la connexion se situe dans les neurones pyramidaux de la Ve couche du cortex. Une étude récente (Parent and Parent[7] , 2006) montre que, pour le cortex moteur du primate en particulier, quelques éléments cortico-striataux peuvent être formés de collatérales d'axones descendant plus bas dans le système nerveux. Mais chez le primate, la majorité des axones corticostriés sont monocibles (non branchés jusqu'à leur arrivée au striatum), fins et peu myélinisés; ce qui est une raison probable de leur découverte tardive. La connexion corticostriaire est glutamatergique, excitatrice.
Cette connexion n'est pas topologiquement aussi simple que cela avait été proposé dans le modèle de Kemp et Powell (1970) où le cortex frontal projetait antérieurement, le parieto-occipital postérieurement et le temporal ventralement. Une partie de ce plan reste sous-jacent mais la distribution est bien plus complexe. Golman et Nauta (1977) et Selemon et Goldman-Rakic (1985) ont montré qu'un seul point cortical peut envoyer des ilots d'arborisations axonales terminales sur une grande distance striatale. Opposé au précédent modèle antéropostérieur, il a été ainsi proposé un modèle parasagittal; mais lui aussi n'est seulement que partiellement vrai.
La connexion corticostriée est en fait le lieu de séparation ou de regroupement d'information à un point donné du striatum. Des axones d'aires corticales distinctes peuvent terminer systématiquement ensemble ou au contraire systématiquement séparément. Il existe de plus une réorganisation spatiale, un « remapping » (Flaherty and Graybiel[8], 1991), refaçonnage de la carte.
La connexion corticostriée est la première d'une chaine d'une forte réduction des nombres entre neurones émetteurs et receveurs, c.a.d. une convergence numérique; ce qui n'est jamais anodin (Percheron et al.[9] 1987). Son effet est que chaque neurone striato-cortical ayant son propre message va être mélangé ou comprimé. Ceci mène à une moindre précision de la carte d'entrée (input map ou inmap) mais à une grande souplesse de combinatoire.
Striatum. Cœur des ganglions de la base A.
Structure, anatomie et constitution
Éléments neuronaux
 Neurones épineux du striatum, d'après Purves D et als[6]
Neurones épineux du striatum, d'après Purves D et als[6]
La neuromorphologie quantitative (et typologique) étendue (Yelnik et al.[10] 1987) a établi que le striatum du primate (noyau caudé et putamen) est composé de quatre (et seulement quatre) genera neuronaux :
- les neurones épineux moyens (« spiny ») (96 %) très dominants
- les neurones leptodendritiques (2 %),
- les arachniformes (« spidery ») (1 %) et
- les microneurones (1 %).
Les arborisations dendritiques des neurones épineux sont sphériques, sauf si elles sont près d'un bord. Leur diamètre dépend de l'espèce animale considérée. Les épines, abondantes, sont de petits renflements du même type que ceux de deux autres genera acanthodendritiques (acanthos signifiant épine) de deux autres régions télencéphaliques acanthodendritiques (les neurones pyramidaux du cortex cérébral et les neurones épineux de l'amygdale). La plupart des épines du striatum font synapses avec des afférences corticales. L'activité spontanée des neurones épineux est, de manière surprenante, « basse ou absente » (DeLong, 1980). Les neurones épineux sont en fait activés par les stimulations corticales. Dans le striatum sensorimoteur, ils répondent aux mouvements. Les axones des neurones épineux (comme les neurones pyramidaux) ont des branches collatérales initiales abondantes et denses (d'une étendue proche de celle de l'arborisation dendritique) qui sont capables d'agir rapidement sur les neurones environnants (Czubayko and Plenz, 2002), ce qui veut dire que les neurones striataux peuvent agir par groupes. La partie longue de l'axone est myélinisée. Les neurones épineux sont GABAergiques et établissent le premier lien d'un 2-chemin inhibiteur si particulier au système.
Les neurones leptodendritiques (ou de Deiters), se colorent fortement pour la parvalbumine et ont toutes les caractéristiques des neurones pallidaux.
Les neurones arachnifomes sont spécifiques aux primates. Ils ont un gros soma et des arborisations dendritiques et axonales denses mais de faible étendue. Ce sont les neurones cholinergiques du primate. Leur dimensions et distribution ne leur permettent pas de couvrir la totalité du volume striatal (Yelnik et al[10] 1987). Ceci doit rendre les comparaisons physiopathologiques entre espèces particulièrement prudentes. Ils forment les « tonically active neurons » or TANs (Kimura et al.[11] 2003). Ils constituent par ailleurs un ensemble de pacemakers lents (Surmeier et al.[12] 2005) dont l'activité est liée à la récompense. Leur faibles nombre et distribution n'en font donc pas des éléments accessoires pour autant.Les microneurons sont des neurones de circuiterie locale semblable à ceux que l'ont trouve dans le thalamus par exemple. Ils sont GABAergiques et pour certains dopaminergiques (Cossette et al.[13] 2005).
Niveaux d'organisation
Subdivisions anatomofonctionnelles
Il y a plusieurs niveaux d'organisation du thalamus. La forte séparation du striatum réalisée par les faisceaux d'axones de lacapsule interne crée la subdivision anatomique traditionnelle entre putamen, caudé et fundus. En fait le striatum est une masse neuronale fendue mais continue, de topologie torique. Les subdivisions classiques ne correspondent pas exactement aux subdivisions fonctionnelles admises chez le primate. Celles-ci correspondent d'avantage aux territoires corticostriés.
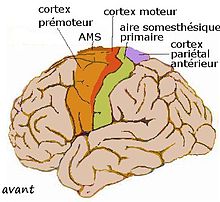
Les terminaisons axonales de la région centrale du cortex (Bailey et von Bonin, 1941) comprenant le cortex moteur, prémoteur, la aire motrice supplémentaire (AMS), l'aire somesthésique primaire et le cortex pariétal antérieur forment le territoire sensorimoteur, ou, en court, le striatum sensorimoteur. Il est essentiellement putaminal mais ne comprend pas tout le putamen. Il s'étend par contre dans les franges striatales et au bord latéral du caudé (Percheron 1984 d'après Künzle 1975 et autres). Il est organisé de manière somatotopique grossière avec trois bandes obliques pour le membre supérieur superolatéralement, le membre inférieur et la face, ventromédialement.
À ce territoire sensorimoteur s'oppose le territoire dit « associatif », réalisé par les cortex frontal, pariétal, préoccipital et temporal et, à souligner, le cortex oculomoteur. Ce territoire est essentiellement caudé mais sans couvrir la totalité du noyau. La séparation entre les deux territoires peut en certains endroits être nette et révélable par la coloration immunochimique de la calbindine (le sensorimoteur est négatif) (François et al.[14]).
L'isolement d'un troisième élément, souvent qualifié de « limbique », est plus difficile. La qualification de limbique est déjà problématique (voir système limbique). Il n'y a pas de frontière nette avec le territoire associatif. Une partie seulement du fundus classique représente une entité (phylogénétiquement régressive), le nucleus accumbens (en fait une pars ayant une constitution de base identique à celle du reste du striatum et non un noyau). Le striatum accumbens (d'« accumbens septi » reposant contre le septum) a quelques propriétés histoimmunologiques particulières. Sa caractéristique essentielle est de recevoir des axones du subiculum (de l'hippocampe). Il existe une littérature considérable, non exempte d'idéologie, sur une sous partie « limbique » du striatum et du système des ganglions de la base. On se doit d'être très prudent dans un terrain peu respectueux des différences phylogénétiques et d'a priori philosophiques (passion contre raison). Dans le striatum accumbens, on oppose une coque (« shell ») à un cœur («core). Chez le primate, ils sont de petite taille (Brauer et al.[15] 2000) par rapport aux autres parties striatales.
Compartiments
Un autre niveau d'organisation est une opposition entre la matrice et les striosomes. L'un et l'autre sont composés des mêmes éléments neuronaux. C'est l'immunocytochimie qui a révélé des « inhomogenéités » de distributions de molécules. Comme son nom l'indique, la matrice est considérée comme la structure fondamentale dans laquelle se différencient les striosomes. Ceux-ci ont été d'abord différenciés par leur contenance en récepteurs opiacés (Pert, ). Ils se colorent aussi pour l'acétylcholinestérase. Cette opposition est surtout nette dans la tête du noyau caudé mais n'est pas évidente partout. Les striosomes n'ont pas de lien avec les afférences provenant de l'amygdale. Ils représenteraient plutôt la ségrégation en ilôts de terminaisons axonales frontales (orbitofrontal postérieur, insula antérieure, médiofrontale et cingulaire antérieures (Eblen and Graybiel[16],1995)).
Les neurones « matriciaux » sont ceux qui sont contenus dans la matrice. Les neurones striosomaux sont ceux qui sont contenus dans les striosomes . Les striosomes chez le primates forment des noyaux fermés (Yelnik et al. 1994). Les deux ont été présentées comme des sources d'efferences distinctes, ce qui va être montré plus loin être discutable.
Hodologie[N 2] vers les cibles
Des différents importants ont porté sur l'origine des neurones striataux envoyant leurs axones à telle ou telle cible (il faut dire que pendant longtemps on a même pensé que les neurones épineux n'avaient pas d'axones longs et n'étaient que des neurones de circuiterie locale!). Les neurones épineux ont en fait tous des axones longs qui forment un faisceau majeur du cerveau. Du fait de difficultés liées à la géométrie de l'ensemble, on a pensé un temps qu'il y avait des neurones striato-pallidaux et des striato-nigraux distincts ayant chacun des particularités histochimiques. Ceci a été la base de modèles que l'on a beaucoup et depuis assez longtemps surexploités. Une étude récente chez le macaque (Levesque and Parent[17], 2005), suivant une autre chez le rat, a bouleversé la situation. Les neurones épineux ont en général plusieurs cibles. Ce dispositif n'est pas un reste archaïque puisque il est rencontré dans 90 % chez le macaque et seulement dans 63,6 % chez le rat. Virtuellement tous les neurones épineux ont le pallidum latéral (le plus volumineux) comme première cible. 24 sur 27 des neurones étudiés projettent aux trois cibles consécutives du cœur des ganglions de la base: pallidum latéral, pallidum médial et nigra (lateralis and reticulata). Il n'existe pas d'axones striataux envoyant d'axones vers le seul pallidum médian ou la seule substance noire ni à ces deux seuls.
La différence de configuration axonale entre les neurones matriciels ou striosomaux n'est observable que dans la substance noire. Les neurones striosomaux traversent toute l'étendue latéro-médiane de la substance noire en émettant 4 à 6 branches ou bouquets verticaux formant des colonnes verticales, s'enfonçant profondément dans la pars reticulata. Les neurones matriciels émettent moins de branches, plus dispersées.
Cette connectivité qui rend caduque des études moins fines pose des problèmes. Le médiateur principal de la connexion striato-pallidonigrale est le GABA, mais elle a des comédiateurs. Depuis Haber et Elde[18] (1981), on sait que le pallidum latéral contient de la met-enképhaline en contraste avec le pallidum médian qui contient lui de la substance P et/ou de la dynorphine. Comme ces cibles sont atteintes par les mêmes arbres axonaux, ceci signifierait qu'un axone individuel est capable de concentrer des comédiateurs différents dans des sous-arbres en fonction de la cible. Ceci modifie considérablement des modèles proposés depuis plusieurs décades et pose de nouvelles questions.
Ensemble et pacemaker pallido-nigral. Cœur B
Constitution
Le cœur des ganglions de la base est l'ensemble formé par le striatum et ses cibles, atteintes par l'intermédiaire du faisceau striatopallidonigral. Cet ensemble est constitué essentiellement de grands neurones peu ramifiés se colorant fortement pour la parvalbumine et qui sont GABAergiques plus de rares microneurones de circuiterie locale (GABAergiques aussi). La distribution et la synaptologie striatopallidonigrale est si particulière qu'elle a pu être utilisée par Fox et al.() pour établir les homologies avec les oiseaux. La physiologie aussi est particulière, l'ensemble pallidonigral formant un pacemaker (rythmeur) autonome rapide.
Pallidum (ou globus pallidus)
Le pallidum, en contraste avec le sriatum est constitué de grands neurones dont les arborisations dendritiques sont discoidales et plates. Elles sont parallèles entre elles et au bord latéral du pallidum, amenant une organisation feuilletée de la structure (Yelnik et al. 1994). Elles sont ainsi perpendiculaires aux afférences striatales qui arrivent latéralement (Percheron et al.[19] 1994). La structure feuilletée est reprise par les afférences. A l'extrémité distale des longues dendrites on observe des arborisations complexes (di Figlia et al., François et al. 1994) dont on ne connait pas encore le rôle. Les grands neurones ont une arborisation axonale proximale, mais peu dense et peu longue.
Pallidum latéral (globus pallidus externe, GPe)
Le pallidum latéral[N 3] est très étendu (parasagittalement et dorsoventralement) et mince médiolatéralement. En plus de l'afférence striatale, le striatum latéral reçoit une afférence majeure du noyau sous-thalamique avec qui il forme un sous -système (voir plus loin). Il reçoit aussi des afférences dopaminergiques de la nigra compacta. Le pallidum latéral est la partie la plus ancienne phylogénétiquement. Contrairement à d'autres subdivisions pallidonigrales (pallidum médian et nigra reticulata), il n'est la source d'aucune sortie vers le thalamus, et de là vers le cortex. Encore, contrairement aux autres éléments du cœur des ganglions de la base, il envoie ses axones essentiellement aux autres ganglions de la base dont il contrôle l'activité par des synapses sur ou proches des somas. De ce point de vue, il peut être considéré comme un régulateur des ganglions de la base (les autres sont décrits plus loin). Contrairement à celle du pallidum médian, l'activité spontanéee, très rapide (rythmeur rapide), est discontinue avec de longs intervalles de silence (DeLong). Les neurones pallidaux latéraux sont souvent multicibles selon plusieurs combinatoires (hodotypes voir Fundamental neuromorphology). D'après Sato et coll[20]. (2000), chez le macaque, les neurones pallidaux latéraux envoient des axones vers le striatum (15,8 %) mais surtout vers trois autres éléments, consécutivement : pallidum médian, nigra reticulata et noyau sousthalamique. Les quantités des axones (hodones) 2-cibles sont pour le pallidum médian et noyau sousthalamique de 18,4 % et pour la nigra reticulata et le noyau subthalamique de 52,6 %. Comme il y a des monocibles pour le noyau sousthalamique dans 23,2 % des cas, le noyau sousthalamique est donc la cible privilégiée dans 84,2 % des cas. Celui-ci en retour envoie la majorité de ses axones vers le pallidum latéral formant un sous système (voir plus bas).
Pallidum médian (globus pallidus interne, GPi)
Le pallidum médian n'apparait que chez le primate. Le noyau entopédonculaire des non-primates n'est pas son équivalent. Il n'a en effet pas de territoire particulier dans le thalamus où ses extrémités axonales se mêlent à celle de la noire. De ce point de vue, il apparait plutôt comme un prolongement intracapsulaire de la noire. Le pallidum médian est séparé en deux parties (latérale et médiale) par la lamina intermedia (dont on ne connait pas la signification). Le pallidum médian, comme les autres éléments de l'ensemble, est un rythmeur rapide (« fast-spiking pacemaker ») avec des décharges spontanées chez le singe éveillé d'environ 90 Hz (Mink and Thach, 1991) ou 70 à 80 Hz (Fillion et Tremblay, 1991). En opposition au pallidum latéral, l'activité rapide y est continue (DeLong, 1960).
En plus de la connexion striatopallidale massive, le pallidum médian reçoit une innervation dopaminergique de la nigra compacta.
Contrairement au pallidum latéral, et comme la nigra reticulata, le pallidum médian est une des source majeure des sorties du système des ganglions de la base.
Sa première composante (10 %) chez le macaque se rend à l'habenula (noyau externe), qui elle-même conduit à un sous-système dont on ne connait pas bien la nature. L'habenula est en effet l'origine d'un faisceau important (« retroflexe » de Meynert) qui se rend au noyau interpédonculaire (faisceau habanulo-interpédonculaire).
L'essentiel des axones pallidaux médians (90 %) se dirige en arrière et au moyen de collatérales fournit successivement la région latérale du thalamus thalamus (VO), la pars media de la région centrale (voir plus bas), le complexe pedunculopontin (Percheron et al., 1996) et l'aire rétrorubrale (Parent and Parent[21], 2004).
Le développement important du pallidum médian dans la phylogenèse produit la création d'un faisceau efférent majeur, faisceau pallido-thalamique formant successivement l'anse et le faisceau lenticulaires, le faisceau en peigne, les champs de Forel H2, H et H1. Les arborisations thalamiques distales fondent l'apparition d'un nouveau noyau le nucleus ventralis oralis, VO. Le médiateur est le GABA.
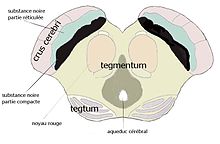
Substantia nigra ou locus niger
La littérature montre qu'il reste difficile d'extraire la substance noire du mésencéphale (des pédoncules) pour les intégrer de plein droit dans le système des ganglions de la base. La (substance) noire est inhomogène et complexe. Une première séparation doit être faite entre deux ensembles distincts, l'ensemble dopaminergique incluant la compacta mais aussi des éléments voisins et l'ensemble pallidonigral continuant en dedans le pallidum au sein du faisceau striatopallidonigral: la pars lateralis and la pars reticulata qui ont la même structure et la même afférence principale que le pallidum.
Nigra lateralis (SNl)
Les neurones nigraux de l'ensemble pallidonigral sont peu branchés et longs (Yelnik, et al.[10] 1987). La différence entre neurones pallidaux et nigraux porte sur l'extension tridimensionnelle des arborisations dendritiques (François et al. 1987). Les dendrites des neurones nigraux ne tendent pas moins à être perpendiculaire aux neurones striataux afférents.
La pars literalis est la partie la plus latérale de la nigra. En général, on n'en fait pas un traitement séparé de la pars reticulata. La différence majeure avec celle-ci est que la SNl envoie des axones aux colliculus supérieurs (Beckstead and Franckfurter, 1982, François et al. 1984). La frontière entre les deux n'est pas claire mais leur participation à des sous-systèmes différents est une raison suffisante pour les distinguer. Les neurones envoyant des axones au colliculus supérieur ont des taux de décharges élevés (80 à 100) et sont impliqués dans les saccades oculaires.
Nigra reticulata(SNr)
La pars reticulata (ou diffusa) est le plus souvent considérée comme formant une entité unique avec la pars lateralis. Le terme de pars reticulata va donc soit désigner la partie la plus médiane de l'ensemble nigral quand la pars lateralis est pris en compte soit désigner l'ensemble. En raison de différences majeures entre les espèces, il est bon de savoir quel animal est étudié. Le nom de reticulata est un moyen simple de la distinguer de la pars compacta plus dense. La frontière entre les deux est très contournée avec des franges profondes.
Les neurones du SNr sont du même genre que ceux du pallidum, avec la même arborescence dendritique longue et épaisse. Les axones striatonigraux vennant des striosomes du striatum forment des colonnes verticales entrant profondément dans la pars reticulata (Levesque, Parent 2005). La nigra envoie aussi des axones au complexe pédunculopontin.
La substance noire reticulata est un autre rythmeur rapide « fast-spiking pacemaker » (Surmeier et al[22] 2005).
Pacemaker pallidonigral
Une des découvertes récentes les plus importantes est le fait que la machinerie du système des ganglions de la base n'est pas mise en mouvement par les seules informations afférentes. On a en effet trouvé des « pacemakers » autonomes ou rythmeurs autonomes, définis comme des « ensembles de neurones capables de décharges périodiques en absence d'input synaptique » (Surmeier et al. 2005), c.a.d. capables de produire une activité propre. L'ensemble pallidonigral est l'un d'entre eux. Parmi les pacemakers autonomes, il appartient à la catégorie des pacemakers rapides « capables de taux de décharges dépassant 200 Hz pendant des périodes étendues » (Surmeier et al.[22] 2005). La régularité et la fréquence des pacemakers est liée aux canaux « cyclic nucleotide-gated » (HCN2 and HCN1, Chan et al. 2004) présents sur les dendrites des neurones pallidaux, modulés par les axones striato-pallidaux.
Le système des ganglions de la base étant très évolutif, l'interprétation doit être précise. La majorité de ce que l'on sait de ces pacemakers a été obtenu sur tranches cérébrales de rongeurs. Ceux-ci sont dépourvus de pallidum médian. Ce qui est dit concerne donc le seul pallidum latéral, inclus dans un sous-système particulier.
Connexion striato-pallidonigrale
Convergence et ajustement
Après la réduction majeure du nombre de neurones entre le cortex et le striatum (voir connexion corticostriée), la connexion striato-pallidonigrale correspond à une autre réduction forte du nombre de neurones récepteurs par rapport à celui des émetteurs. Les nombres donnés par Percheron et al. (1987, 1989) sont de 31 millions de neurones épineux chez le macaque. Il y a 166 000 neurones pallidaux latéraux, 63 000 pallidaux médians, 18 000 nigraux latéraux et 35 000 neurones dans la pars reticulata, ce qui fait 283 000 neurones cibles. Si l'on divise le nombre des neurones striataux par ce nombre on trouve que chaque neurone cible peut recevoir en moyenne des informations de 117 neurones striataux. Les nombres sont chez l'homme de 555 000 neurones pallidaux latéraux, 1 570 000 neurones pallidaux médians et de 167 000 neurones nigraux (pars lateralis + reticulata). Une autre approche, différente, part de la surface membranaire moyenne des neurones pallidonigraux et du nombre de synapses striatales qu'elles peuvent recevoir. Chaque neurone pallidonigral peut ainsi recevoir environ 70000 synapses. Chaque neurone striatal peut ainsi contribuer à 680 synapses. Ceci mène à la même approximation de 100 neurones striataux pour un neurone cible ce qui représente une réduction majeure inhabituelle dans les connexions neuronales.
Synaptologie et combinatoire
La synaptologie de la connexion striato-pallidonigrale est si particulière qu'elle peut être reconnue facilement. Les dendrites pallidonigrales sont entièrement couvertes de synapses sans aucune apposition de glie (Fox et al.,1974, Di Figlia et al. 1982). Dans les coupes, ceci apparaît sous forme d'images caractéristiques de « palissades » ou de « rosettes ». Plus de 90 % de ces synapses sont d'origine striatale. Au milieu des synapses GABAergiques striatonigrales sont parsemées quelques rares synapses dopaminergiques et cholinergiques. La manière dont les axones striataux distribuent leurs synapses est encore une question débattue.
Physiopathologie
Les effets de la lésion bilatérale du pallidum n'est plus prise en considération dans les travaux récents. Pourtant ses effets sont considérables et devraient être introduits dans la base des raisonnements. Ces destructions peuvent être anoxiques, le pallidum étant avec le « champ de Sommer » hippocampique l'endroit le plus sensible à la baisse d'oxygène. Ceci est corrélé avec des taux extrêmement élevés d'enzymes oxydatifs et surtout à la présence de métaux lourds. Le faisceau striato-pallidonigral contient du fer (xx), du manganèse, du cobalt.
La destruction peut-être toxique en particulier par le SH ou des pesticides.
L'atteinte pallidale bilatérale mène à des syndromes très graves avec une akinésie et des signes posturaux considérables.
Nigra compacta (SNc)(locus niger) et éléments dopaminergiques voisins
Stricto sensu, la pars compacta est une partie du cœur des ganglions de la base puisqu'elle reçoit des synapses des axones striataux par le faisceau striato-pallidonigral.
Structure
Les longues dendrites ventrales de la pars compacta plongent en effet profondément dans la pars reticulata où elles reçoivent des synapses des axones du faisceau (en particulier des axones striatostriosomaux). Toutefois, sa constitution, sa physiologie et son médiateur contrastent avec le reste de la substantia nigra. En dépit de leur intrication topographique, il convient donc d'insister sur la nécessité de séparer fortement deux ensembles neuronaux bien distincts: l'ensemble noir pallidonigral et l'ensemble noir proprement dit.
L'ensemble noir se caractérise par des traits morphologiques distincts. Les arborisations dendritiques sont plus épaisses et plus longues que celles de l'ensemble reticulata-lateralis (François et al. 1999). Un dépôt de neuromélanine qui s'accroit avec l'âge rend les neurones et la structure noire, ce qui est à l'origine du nom de l'ensemble (substantia nigra voulant dire substance noire, terme couramment utilisé). Cet ensemble neuronal n'est pas entièrement « nucléé » (c’est-à-dire inclus dans un système de fermeture (voir theoretical neuromorphology). Des neurones de même genre se trouvent en dehors des limites traditionnelles de la substance noire, plus en arrière dans le tegmentum du mésencéphale, en position prérubrale. Ils y constituent des « groupes » sans frontières claires. Les premières études, déjà anciennes chez le rat, sans possibilité de cartographie plus précise, au lieu de désignations anatomiques, avaient isolé ces groupes avec des numéros. La pars compacta y est nommée A9! Les ensembles plus postérieurs ont été arbitrairement désignés comme « aire A8 » et « A10 ». La pars compacta proprement dite est maintenant subdivisée en un niveau ventral « A9v » et un niveau dorsal « A9d », calbindine positif (François et al.[14], 1994). Celui-ci est en fait lié à un ensemble comprenant A8 and A10 qui représente 28 % des neurones dopaminergiques. Le niveau ventral reçoit des informations striatales par le faisceau striatopallidonigral. Ceci ne peut être le cas des éléments dorsaux et postérieurs que le faisceau n'atteint pas.
Les neurones de la pars compacta à l'opposé de ceux de la reticulata sont des rythmeurs lents ou pacemakers lents (Surmeier et al.[22] 2005), entre 0,2 et 10 Hz (au-dessous de 8, Schultz). Contrairement à ce qui avait été pensé, l'activité des neurones dopaminergiques n'est pas liée au mouvement. Les neurones sont par contre « activés par des stimuli nouveaux, inattendus, par des récompenses primaires en l'absence de stimulus prédictif et durant l'apprentissage » (Schultz).
Cibles de l'ensemble dopaminergique
L'ensemble des axones des neurones dopaminergiques forment le faisceau nigrostrié (ou nigrostriatal). Celui-ci débute à la partie superomédiane de la noire et monte presque verticalement jusqu'au bord médian du noyau sous-thalamique. Là, il s'incline pour longer son bord supérieur. Ensuite il traverse la capsule interne et atteint le coin superomédian du putamen.
Régulateurs du cœur des ganglions de la base
Noyau sous-thalamique, ou corps de Luys
Comme cela est indiqué par son nom, le noyau sous-thalamique (nucleus subthalamicus) est situé au-dessous du thalamus. Il est dorsal par rapport à la substance noire et médial par rapport à la capsule interne. Le noyau a une forme lenticulaire et un aspect homogène. Il est constitué d'une espèce neuronale particulière qui a des arborisations dendritiques plutôt longues ellipsoïdales dépourvues d'épines, réplicant en plus petit la forme générale du noyau (Yelnik and Percheron[23],1979).
Les neurones sous-thalamiques forment un rythmeur rapide (fast-spiking pacemaker) déchargeant à 80-90 Hz (Surmeier et al.[22] 2005). Il y a environ 7,5 % de microneurones GABAergiques participant aux circuits locaux (Levesque and Parent 2005).
Le noyau sous-thalamique reçoit ses afférences principales du pallidium latéral. Une autre afférence, de nature glutamergique, vient du cortex, en particulier du cortex moteur. Les axones sous-thalamiques quittent le noyau dorsalement. Exception faites des connexions au striatum (17,3 % chez le macaque), la plupart des neurones sont multicibles et se dirigent vers les autres élements du cœur des ganglions de la base (Sato et al 2005).
Sous-système sous-thalamo-latéropallidal
Comme il a été dit plus haut, le pallidum latéral n'a de cibles qu'intrinsèques au système des ganglions de la base. Il est particulièrement lié dans les deux directions au noyau sous-thalamique.
Contrairement aux deux éléments de sortie (pallidum médian et nigra reticulata), ni le pallidum latéral ni le noyau sous-thalamique n'envoie d'axones au thalamus. Le pallidum latéral reçoit un apport massif d'axones striataux et est à ce titre un élément du cœur des ganglions de la base et ne reçoit pas d'axones corticaux. Le noyau sous-thalamique ne reçoit pas d'afférences striatales et à ce titre n'est pas un élément du cœur. Il reçoit par contre des afférences corticales.
Le pallidum latéral et le noyau sous-thalamique sont tous deux des pacemakers rapides (Surmeier et al., 2005). La connexion pallido-sous-thalamique est inhibitrice (GABA). La connexion sous-thalamo-pallidale est excitatrice (glutamate). Les deux ensembles qui sont des régulateurs couplés constituent le « pacemaker central des ganglions de la base » (Plenz and Kitai,1999) avec des bouffées synchrones.
Région centrale (C)
Cette région, située dans la partie inférieure du thalamus, correspond à ce qui est souvent appelé le complexe centre médian-parafasciculaire (voir Percheron et al. 1991).
Contrairement à ce qui est dit communément depuis LeGros Clarcke, il n'appartient pas topographiquement, histologiquement ni fonctionnellement au groupe des noyaux intralaminaires. Situé à la partie inférieure du thalamus, il est presque partout entouré d'une capsule qui en font une région fermée. Chez le primate supérieur, partant des cercopithecidae, il est fait non pas de deux mais de trois éléments ayant chacun une espèce neuronale propre (Fenelon et al. 1994) distribuées de médialement à latéralement. Deux interprétations ont été proposées pour l'appartenance de la partie intermédiaire: soit partie du centre médian (les Vogts, 1941) soit du parafasciculaire (Niimi et al. 1960). Comme ceci est difficilement décidable, il a été proposé de grouper les trois éléments dans la regio centralis (puisqu'il s'agit d'un noyau thalamique classique) et de désigner de dedans en dehors les pars parafascicularis, pars media et pars paralatéralis. L'ensemble est riche en parvalbumine. Les deux parties les plus médianes sont riches en cholinestérase.
Complexe pédunculopontin
Le complexe pédonculopontin n'est pas une partie primaire des ganglions de la base mais un constituant de la formation réticulée (Mesulam et al. 1989) ayant de forts liens avec les ganglions de la base. Comme son nom l'indique, il se trouve à la jonction du pont et des pédoncules cérébraux, en position latérale à la décussation du brachium conjunctivum.
C'est un complexe non homogène. Une partie importante est faite de neurones cholinergiques (Ch5) excitateurs, les autres neurones étant GABAergiques. Le suivi des axones du complexe pédunculopontin a montré qu'ils se terminaient surtout dans la nigra reticulata et la pars compacta. D'autres innervations ont été observées dans les noyaux sous-thalamiques (Lavoie et Parent, 1994), le pallidium médian et le striatum.
Le complexe reçoit de nombreuses afférences directes du pallidum médian, inhibitrices (Percheron et als 1998). Ceci a conduit Mena-Segovia et als (2004) a proposer que le complexe est lié d'une manière ou d'une autre au système des ganglions de la base. Il joue un rôle important dans le l'éveil et le sommeil (Pahapill and Lozano, 2000).
Le complexe pédunculopontin a donc une double position et fonction :- il fait partie de la formation réticulée
- c'est un régulateur des ganglions de la base.
Efférences du système des ganglions de la base
La plupart des connexions des ganglions de la base se font à l'intérieur de ce complexe, les quelques efférences concernent le colliculus supérieur à partir de la nigra lateralis, le thalamus et de là le cortex. Les terminaisons pallidales et nigrales sont complètement séparées.
Nigra lateralis vers le colliculus supérieur
La nigra lateralis, faite du même type de neurones que la pars reticulata, s'en distingue par ses cibles. La connexion, maintenant bien établie avec le tectum chez le macaque (Jayaraman et al.1977, François et al.1984) n'a pas reçu sa pleine reconnaissance. Les colliculus supérieurs (du tectum) envoient des axones aux aires VlmM, VA, Cpf du thalamus qui sont liées au cortex oculomoteur. En outre, la nigra lateralis envoie, via un relai thalamique, des informations aux cortex prémoteur et frontal (Middleton and Strick[24] , 2002).
Du pallidum médian vers le thalamique VO et le cortex
Les axones provenant du pallidium et se dirigeant vers le thalamus forment l'ansa lenticularis (dans le sous-thalamus) et le lenticular fasciculus, formant en fait une seule entité. Quand les axones arrivent à la face médiane du pallidium, ils traversent la capsule interne où ils forment de système du peigne ("Kamm system" of Edinger, 1900). Lorsqu'ils arrivent au bord latéral du sous-thalamus, ils le contournent par dessus en formant le champ H2 de Forel (1877), puis ils se courbent vers l'hypothalamus et remontent dans la direction dorsolatérale et atteignent le thalamus dans la région ventrale. Les axones pallidaux ont leur propre territoire thalamique dans la région latérale, séparée de toutes parts des territoires cérébelleux et nigraux. Le noyau reste latéral chez le macaque et l'homme. Les neurones thalamocorticaux du VO vont préférentiellement à l'aire motrice supplémentaire (AMS), à la préAMS et dans une moindre mesure dans le cortex moteur. Les neurones pallidothalamiques donnent aussi des branches à la pars media du complexe central, qui se projette sur le cortex prémoteur et accessoire.
De la nigra reticulata vers le VA thalamique et le cortex
Les axones de la nigra reticulata montent dorsalement sans former clairement un faisceau distinct. Ils atteignent le thalamus au niveau inferomédian. La cible nigrale, le territoire thalamique VA, est médian par rapport au pallidal VO. Elle est croisée par le faisceau mammillothalamique. Chez l'homme la majorité du noyau est constituée d'un composant magnocellulaire.
En plus des afférences nigrales, le territoire VA reçoit des axones du tectum (colliculus supérieur) et de l'amygdale (complexe de base).
Les projections thalamocorticales partant du VA vont vers les aires prémotrices, le cortex cingulaire antérieur et le cortex oculomoteur, sans connexion significative au cortex moteur du gyrus précentral. Cet ensemble de sorties thalamocorticales est distinct de celui du VO thalamique provenant du pallidum médian.
Sous systèmes et modèles
Les représentations systémiques utilisent de manière ordinaire le « schéma boîte-flèche » où les éléments sont des boîtes et les connexions de simples flèches. Les « boîtes » sont supposées être clairement distinctes des autres, closes et homogènes. Les flèches n'ont pas de poids en nombre d'axones, ni de combinatoire. Dans des modèles récents, le cortex est réduit à une boîte (comme si cela était possible) et le thalamus « moteur » à une autre boîte mêlant indument le thalamus cérébelleux d'une part et le « thalamus des ganglions de la base », pourtant soigneusement séparé en thalamus pallidal et thalamus nigral. Le (VA-VL complex) n'a aucun fondement mais une grande puissance dévastatrice pour comprendre le système.
Notes
- ou corticostriaire ou moins légitimement, corticostriatale
- (médecine) étude de la connectivité entre les neurones
- latéral = sur le côté extérieur, donc pallidum latéral = globus pallidus externe
Références
- Hasboun
- Percheron, G., Fénelon, G., Leroux-Hugon, V. and Fève, A., « Histoire du système des ganglions de la base », dans Rev. Neurol, vol. 150, 1994
- Fox C.A, Andrade A.N, Lu Qui I.J, Rafols J.A., « The primate globus pallidus: a Golgi and electron microscopic study. », dans J Hirnforsch., vol. 15, no 75, 1974
- Percheron, G.,François, C, Parent, A.Sadikot, A.F., Fenelon, G. and Yelnik, J., « The primate central complex as one of the basal ganglia », dans in The Basal Ganglia III Bernardi, G. et al. (eds) pp. 177–186. Plenum . New York, 1991
- Poly Hasboun
- Dale Purves, George-J Augustine, David Fitzpatrick, et W-C Hall, Neurosciences, De Boeck, 2005 (3eéd.)
- Parent, M. and Parent, M., « Single-axon tracing study of corticostriatal projections arising from primary motor cortex in primates », dans J. Comp. Neuro., vol. 496, 2006, p. 202-216
- Flaherty, A.W and Graybiel,, « Corticostriatal transformations in the primate somatosensory system . Projections from physiologically mapped body-part representations », dans J. Neurosci., vol. 66, 1991, p. 1249-1263
- Percheron, G., François, C. and Yelnik, J., « Spatial organization and information processing in the core of the basal ganglia. », dans in Carprenter, M.B., Jayaraman, A.(eds) The basal Ganglia II.Plenum, Adv. Behav. Biol. 32 pp. 205–226., 1987
- Yelnik, J., François, C., Percheron, G., Heyner, S, « Golgi study of the primate substantia nigra. I. Quanttitative morphology and typology of nigral neurons. », dans J. Comp. Neurol., vol. 265, 1987, p. 455-472
- Kimura, M., Yamada, H. and Matsumoto, « Tonically active neurons in the striatum encode motivational contexts of actions », dans Brain and develop., vol. 25, 2003'
- Surmeier, D.J., Mercer, J.N. and Savio Chan, C, « Autonomous pacemakers in the basal ganglia: who needs excitatory synapses anyway? », dans Cur. Opin. Neurobiol., vol. 15, 2005
- Cossette, M., Lecomte, F., Parent, A., « Morphology and distribution of dopaminergic intrinsic to the human striatum », dans J.Chem. Neuroanat., vol. 29, 2005
- François, C., Yelnik, J.,Percheron, G.and Tandé,, « Calbindin-D-28K as a marker of the associative coertical territory of the striatum of macaques », dans Brain Res., vol. 633, 1994, p. 331-336
- Brauer, K, Haüsser, M., Härtig, W. and Arendt, T., « The shell-core dichotomy of nucleus accumbens in the rhesus monkey as revealed by double-immunofluorescence and morphology of cholinergic interneurons », dans Brain Res., vol. 858, 2000, p. 151-162
- Eblen, F, Graybiel, A.M, « Highly restricted origin of prefrontal cortical inputs to striosomes in monkeys », dans J. of Neurosci., vol. 15, 1995, p. 5999-6013
- Levesque, J.C. and Parent A, « GABAergic interneurons in human subthalamic nucleus », dans Mov. Disord., vol. 20, 2005
- Haber, S. and Elde, R., « Correlation between Met-enkephalin and sustance P immunoreactivity in the primate globus pallidus. », dans Neurosci., vol. 6, 1981, p. 1291-1297
- Percheron G, Yelnik J, François C, Fénelon G, Talbi B., « Informational analysis of the basal ganglia related system », dans Rev Neurol, vol. 150, no 8-9, 1994
- Sato, F., Lavallée, P., Levesque, M. and Parent, A., « Single-axon tracing study of neurons of the external segment of the globus pallidus in primate. », dans J. Comp. Neurol., no 417, 2000, p. 17-31
- Parent, M. and Parent, M., « The pallidofugal motor fiber system in primates. », dans Park. Relat. Disord, vol. 10, 2004, p. 203-211
- Surmeier, D.J., Mercer, J.N. and Savio Chan, C, « Autonomous pacemakers in the basal ganglia: who needs excitatory synapses anyway? », dans Cur. Opin. Neurobiol., vol. 15, 2005, p. 312-318
- Yelnik, J. and Percheron, G., « Subthalamic neurons in primates: a quantitative and comparative analysis », dans Neuroscience, vol. 4, 1979, p. 1717-1743
- Middleton, F.A and Strick, P.L, « Basal ganglia "projections" to the prefrontal cortex of the primate », dans Cereb. Cortex., vol. 12, 2002, p. 926-935
Voir aussi
- subthalamo-lateropallidal pacemaker
Wikimedia Foundation. 2010.