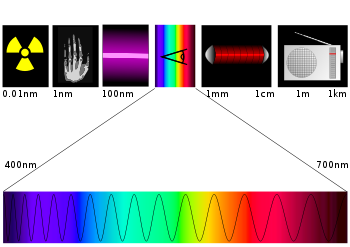
- Spectre hertzien
-
Spectre électromagnétique
Le spectre électromagnétique est la décomposition du rayonnement électromagnétique selon ses différentes composantes en termes de fréquence (ou période), d'énergie des photons ou encore de longueur d’onde associée, les quatre grandeurs ν (fréquence), T (période), E (énergie) et λ (longueur d’onde) étant liées deux à deux par :
- la constante de Planck
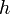 (approx. 6,626069×10-34 J⋅s ≈ 4,13567 feV/Hz)
(approx. 6,626069×10-34 J⋅s ≈ 4,13567 feV/Hz) - et la vitesse de la lumière
 (exactement 299 792 458 m/s),
(exactement 299 792 458 m/s),
selon les formules :
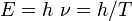 pour l’énergie transportée par le photon,
pour l’énergie transportée par le photon,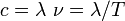 pour le déplacement dans le vide (relativiste dans tous les référentiels) du photon,
pour le déplacement dans le vide (relativiste dans tous les référentiels) du photon,
d’où aussi :
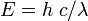 .
.
Sommaire
Histoire
Le terme spectre fut employé pour la première fois en 1666 par Isaac Newton pour se référer au phénomène par lequel un prisme de verre peut séparer les couleurs contenues dans la lumière du Soleil.
Unités de mesures
Pour les ondes radio et la lumière, on utilise habituellement la longueur d'onde. À partir des rayons X, les longueurs d'ondes sont rarement utilisées : comme on a affaire à des particules très énergétiques, l'énergie correspondant au photon X ou γ détecté est plus utile. Cette énergie est exprimée en électron-volt (eV), soit l'énergie d'un électron accéléré par un potentiel de 1 volt.
Spectre lumineux
La lumière blanche peut se décomposer en arc-en-ciel à l'aide d'un prisme ou d'un réseau de diffraction. Chaque « couleur spectrale » de cette décomposition correspond à une longueur d’onde précise ; cependant, la physiologie de la perception des couleurs fait qu'une couleur vue ne correspond pas nécessairement à une radiation de longueur d’onde unique mais peut être une superposition de radiations monochromatiques. La spectrométrie étudie les procédés de décomposition, d’observation et de mesure des radiations en ondes monochromatiques.
Les photons de lumière visible les plus énergétiques (violet) sont à 3 eV. Les rayons X couvrent la gamme 100 eV à 100 keV. Les rayons γ sont au-delà de 100 keV. Des photons γ de plus de 100 MeV (100 000 000 eV) émis par un quasar ont été détectés.
Usages et classification
Les définitions des bandes mentionnées dans le tableau sont les suivantes (normalisation internationale effectuée par l’UIT) ; elles sont aussi communément désignées par leur catégorie de longueur d’onde métrique (dans le tableau ci-dessous, les longueurs d'onde sont calculées avec l'approximation courante
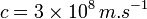 sauf pour la bande THF)
sauf pour la bande THF)Bandes Fréquences Longueur d’onde Usages Ondes TLF (Tremendously Low Frequency) 0 Hz à 3 Hz 100 000 km à ∞ Champs magnétiques, ondes et bruits électromagnétiques naturels, ondes gravitationnelles Ondes ELF (Extremely Low Frequency) 3 Hz à 30 Hz 10 000 km à 100 000 km Ondes électromagnétiques naturelles, résonance terrestre de Schumann, ondes du cerveau humain, recherches en géophysique, raies spectrales moléculaires Ondes SLF (Super Low Frequency) 30 Hz à 300 Hz 1 000 km à 10 000 km Ondes électromagnétiques naturelles, résonance terrestre de Schumann, ondes physiologiques humaines, ondes des lignes électriques, usages inductifs industriels, télécommandes EDF Pulsadis, harmoniques ondes électriques Ondes ULF (Ultra Low Frequency) 300 Hz à 3 kHz 100 km à 1 000 km Ondes électromagnétiques naturelles notamment des orages solaires, ondes physiologiques humaines, ondes électriques des réseaux téléphoniques et ADSL, harmoniques ondes électriques, signalisation TVM des TGV Ondes VLF (Very Low Frequency) 3 kHz à 30 kHz 10 km à 100 km Ondes électromagnétiques naturelles, radiocommunications submaritimes militaires, transmissions par CPL, systèmes de radionavigation, émetteurs de signaux horaires Ondes LF (Low Frequency) 30 kHz à 300 kHz 1 km à 10 km Ondes électromagnétiques naturelles des orages terrestres, radiocommunications maritimes et submaritimes, transmissions par CPL, radiodiffusion en OL, émetteurs de signaux horaires, systèmes de radionavigation Ondes MF (Medium Frequency) 300 kHz à 3 MHz 100 m à 1 km Systèmes de radionavigation, radiodiffusion en OM, radiocommunications maritimes et aéronautiques, radioamateurs, signaux horaires Ondes HF (High Frequency) 3 MHz à 30 MHz 10 m à 100 m Radiodiffusion internationale, radioamateurs, radiocommunications maritimes et aéronautiques, radiocommunications militaires et d’ambassades, aide humanitaire, transmissions gouvernementales, applications inductives autorisées, signaux horaires, CB en 27 MHz, radar Nostradamus Ondes VHF (Very High Frequency) 30 MHz à 300 MHz 1 m à 10 m Radiodiffusion et télédiffusion, radiocommunications professionnelles, transmissions militaires, liaisons des secours publics, radionavigation et radiocommunications aéronautiques, radioamateurs, satellites météo, radioastronomie, recherches spatiales Ondes UHF (Ultra High Frequency) 300 MHz à 3 GHz 10 cm à 1 m Télédiffusion, radiodiffusion numérique, radioamateurs, radiocommunications professionnelles, transmissions militaires y compris aéronautiques, liaisons gouvernementales, liaisons satellites, FH terrestres, radiolocalisation et radionavigation, services de la DGAC, usages spatiaux, satellites météo, téléphonie GSM et UMTS, liaisons Wi-Fi et Bluetooth, systèmes radar Ondes SHF (Super High Frequency) 3 GHz à 30 GHz 1 cm à 10 cm FH terrestres et par satellite, systèmes radar, liaisons et FH militaires divers, systèmes BLR, radioastronomie et usages spatiaux, radiodiffusion et télédiffusion par satellite, liaisons Wi-Fi, fours à micro-ondes Ondes EHF (Extremely High Frequency) 30 GHz à 300 GHz 1 mm à 1 cm FH terrestres et par satellite, recherches spatiales, radioastronomie, satellites divers, liaisons et FH militaires, radioamateurs, systèmes radar, raies spectrales moléculaires, expérimentations et recherches scientifiques Ondes THF (Tremendously High Frequency) 300 GHz à 300 000 000 THz 0,99 pm à 999,3 µm * Ondes infrarouges C (300 GHz à 100 THz) -
- Infrarouges extrêmes (300 GHz à 19,986 THz)
- Infrarouges lointains (19,986 à 49,965 THz)
- Infrarouges moyens (49,965 à 99,930 THz)
- Infrarouges proches (99,930 à 399,723 THz)
- Ondes infrarouges B (100 à 214 THz)
- Ondes infrarouges A (214 à 374,740 THz)
- Transition vers le rouge (374,740 à 384,349 THz)
- Lumière visible par l’homme (couleurs « spectrales ») :
- Ondes visibles rouges (391,885 à 483,536 THz soit 765 à 620 nm)
- Ondes visibles rouges orangées (483,536 à 503,007 THz soit 620 à 596 nm)
- Ondes visibles jaunes orangées (503,007 à 510,719 THz soit 596 à 587 nm)
- Ondes visibles jaunes (510,719 à 516,883 THz soit 587 à 580 nm)
- Ondes visibles jaunes verdâtres (516,883 à 521,378 THz soit 580 à 575 nm)
- Ondes visibles vertes jaunâtres (521,378 à 535,343 THz soit 575 à 560 nm)
- Ondes visibles vertes (535,343 à 565,646 THz soit 560 à 530 nm)
- Ondes visibles vertes bleutées (565,646 à 609,334 THz soit 530 à 492 nm)
- Ondes visibles cyanes (609,334 à 615,590 THz soit 492 à 487 nm)
- Ondes visibles bleues verdâtres (615,590 à 621,976 THz soit 487 à 482 nm)
- Ondes visibles bleues (621,976 à 644,714 THz soit 482 à 465 nm)
- Ondes visibles indigos (644,714 à 689,178 THz soit 465 à 435 nm)
- Ondes visibles violettes (689,178 à 788,927 THz soit 435 à 380 nm)
- Transition vers les ultraviolets (788,927 THz à 749,481 THz)
- Rayonnements dits « ionisants » :
- Ultraviolet :
- Ultraviolets UV-A (749,481 THz à 951,722 THz)
- Ultraviolets UV-B (951,722 THz à 1070,687 THz)
- Ultraviolets UV-C (1070,687 THz à 1498,962 THz)
- Ultraviolets V-UV (1498,962 THz à 3 PHz)
- Ultraviolets X-UV, transition vers les rayons X (3 PHz à 300 PHz)
- Rayons X :
- Rayons X mous (300 PHz à 3 EHz)
- Rayons X durs (3 EHz à 30 EHz)
- Rayons gamma :
- Rayons gamma mous (30 EHz à 300 EHz)
- Rayons gamma durs (au-delà de 300 EHz) (au-delà de la bande THF)
- Ultraviolet :
Spectre d'émission
Des atomes ou molécules excités (par exemple par chocs) se désexcitent en émettant une onde électromagnétique. Celle-ci peut se décomposer en une superposition d'ondes sinusoïdales (monochromatiques) caractérisées par leurs longueurs d'onde. Le spectre est constitué par l'ensemble des longueurs d'ondes présentes. On peut le matérialiser à l'aide d'un prisme de décomposition de la lumière en un ensemble de lignes, les raies spectrales, qui correspondent aux différentes longueurs d'ondes émises. Pour plus de précision, on peut également représenter ce spectre comme un graphe de l'intensité lumineuse en fonction de la longueur d'onde.
L'observation du spectre d'émission de l'hydrogène se fait au moyen d'un tube Geissler qui comporte deux électrodes et de l'hydrogène sous faible pression. Les électrodes sont soumises à une différence de potentiel de 1000 V. L'important champ électrique accélère les ions présents qui par chocs excitent les atomes d'hydrogène. Lors de leur désexcitation, ils émettent de la lumière qui est analysée par un spectroscope. Dans tous les cas on observe (dans le visible) le même spectre composé de 4 raies (spectres de raies) aux longueurs d'ondes : 410 nm, 434 nm, 486 nm, 656 nm.
Niels Bohr interprétera alors l'émission de lumière par l'émission d'un photon lorsque l'atome passe d'un niveau d'énergie à un autre. Le spectre d'émission de n'importe quel élément peut être obtenu en chauffant cet élément, puis en analysant le rayonnement émis par la matière. Ce spectre est caractéristique de l'élément.
Spectre d'absorption
Le principe est exactement le même que celui du spectre d'émission : à un niveau d'énergie donné correspond une longueur d'onde. Mais au lieu d'exciter de la matière (par exemple en la chauffant) pour qu'elle émette de la lumière, on l'éclaire avec de la lumière blanche (donc contenant toutes les longueurs d'ondes) pour voir quelles longueurs d'ondes sont absorbées. Les niveaux d'énergie étant caractéristiques de chaque élément, le spectre d'absorption d'un élément est exactement le complémentaire du spectre d'émission. On s'en sert notamment en astrophysique : par exemple, pour déterminer la composition de nuages gazeux, on étudie leur spectre d'absorption en se servant des étoiles se situant en arrière-plan comme source de lumière. C'est d'une manière générale le but de la spectrographie d'absorption : identifier des éléments inconnus (ou des mélanges) par leur spectre.
Voir aussi
Notes et références
Articles connexes
- Portail de la physique
Catégorie : Spectre électromagnétique - la constante de Planck
Wikimedia Foundation. 2010.