- Opéron lactose
-
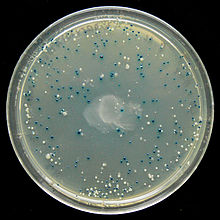 Colonies d'E. coli sur une boîte de Petri contenant du X-gal, donnant leur couleur bleue aux colonies produisant la β-galactosidase et catabolisant donc le lactose.
Colonies d'E. coli sur une boîte de Petri contenant du X-gal, donnant leur couleur bleue aux colonies produisant la β-galactosidase et catabolisant donc le lactose.
L'opéron lactose, ou opéron lac est un opéron nécessaire au transport et au métabolisme du lactose chez Escherichia coli, ainsi que d'autres bactéries de la flore intestinale. L'opéron lactose est composé de trois gènes structurels : lacZ, lacY et lacA. Il est régulé par plusieurs facteurs, notamment la disponibilité en glucose et en lactose. La régulation des gènes de l'opéron lac est le premier mécanisme de régulation génétique complexe à être élucidé et est l'un des exemples des plus connus de la régulation des gènes procaryotes.
Dans son environnement naturel, l'opéron lac permet la digestion efficace du lactose. La cellule peut utiliser le lactose comme source d'énergie en produisant l'enzyme β-galactosidase et ainsi digérer le lactose en glucose et en galactose. Toutefois, la production de l'enzyme est inutile quand le lactose n'est pas disponible, ou si il y a une source d'énergie plus facilement exploitable de disponible comme le glucose. L'opéron lac utilise un mécanisme de contrôle en deux parties qui font que la cellule ne dépense pas d'énergie pour produire la β-galactosidase, la perméase β-galactoside et la thiogalactoside transacétylase (ou galactoside O-acétyltransferase) uniquement lorsque c'est nécessaire. Il y parvient avec le protéine activatrice des catabolites (CAP), dont il active la production en l'absence de glucose. Ce mécanisme à double contrôle entraîne l'utilisation séquentielle de glucose et le lactose en deux phases distinctes de croissance, connue sous le nom diauxie. Des patrons de croissance similaires (diauxiques) ont aussi été observés dans la croissance bactérienne sur des substrats contenant d'autres mélanges de sucres, comme des mélanges de glucose et d'arabinose, etc. Les mécanismes de contrôle génétique sous-jacents à ces schémas de croissance diauxiques sont connus sous les noms d'François Jacob et Jacques Monod le Prix Nobel de physiologie ou médecine de 1965 « pour leurs découvertes concernant le contrôle génétique des synthèse enzymatiques et virales ».
Sommaire
Structure de l'opéron lac

L'opéron est constitué de :
- 3 gènes de structure :
- lacZ codant la β-galactosidase (constitué de 3 072 paires de bases) qui hydrolyse le lactose en glucose et galactose ;
- lacY codant la β-galactoside perméase (1 251 pb), protéine membranaire qui permet la pénétration des β-galactosides contre un gradient de concentration ;
- lacA codant la β-thiogalactoside acétyltransférase (609 pb) permettant à la cellule d'utiliser les thiogalactosides. Seuls lacZ et lacY semblent nécessaires au catabolisme du lactose.
- 2 gènes de contrôle :
- une séquence terminatrice.
En amont de cet opéron l'on trouve aussi un gène régulateur :
- lacI codant le répresseur dont la forme active se place au niveau du gène o et dont la complexation avec l'allolactose (produit secondaire de dégradation du lactose par la β-galactosidase) change sa conformation (il ne peut plus se fixer au gène o).
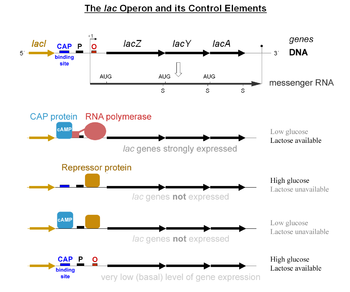
Le contrôle spécifique des gènes lac dépend de la disponibilité en lactose du substrat de la bactérie. Les protéines ne sont pas produites par la bactérie lorsque le lactose n'est pas disponible comme source de carbone. Les gènes lac sont organisés en un opéron, c'est-à-dire qu'ils sont orientés dans le même sens, immédiatement adjacents sur le chromosome et sont co-transcrits en une molécule d'ARNm polycistronique unique. La transcription de tous les gènes commence avec la liaison de l'ARN polymérase, une protéine se liant à l'ADN sur un site de liaison spécifique, ici sur le promoteur, immédiatement en amont des gènes. De cet emplacement l'ARN polymérase transcrit les trois gènes (lacZYA) en ARNm. La séquence d'ADN de l'opéron lac, de l'ARNm lacZYA et du gène lacI de la bactérie E. coli sont disponibles sur GenBank.
Mécanisme de régulation
- Réponse au lactose
Le premier mécanisme de contrôle est la réponse régulatrice au lactose, qui utilise une protéine régulatrice intracellulaire, le répresseur lactose, pour stopper la production de β-galactosidase en l'absence de lactose. Le gène régulateur lacI codant pour le répresseur se trouve à proximité de l'opéron lac et est toujours exprimé (transcrit constitutivement). Cette répression est inhibée en présence de lactose.
- Si le lactose est absent du milieu de croissance, le répresseur se lie très étroitement à une courte séquence d'ADN juste en aval du promoteur au début de lacZ appelée opérateur lac (o), une séquence non codante complémentaire au répresseur. La liaison du répresseur à l'opérateur interfère avec la liaison d'ARN polymérase au promoteur p, et donc l'ARNm codant pour lacZ et lacY est très peu transcrit : le métabolisme du lactose n'est pas possible.
- Sans perméase, le lactose du milieu extérieur pénètre faiblement et est transformé en allolactose, un isomère du lactose, une combinaison de glucose et de galactose. Il se lie au répresseur, provoquant un changement dans sa forme, formant un complexe incapable de se fixer sur le gène o opérateur. L'ARN polymérase peut alors transcrire normalement les gènes de structure lac. Les enzymes nécessaires au métabolisme du lactose sont synthétisées.
- Réponse au glucose
Le second mécanisme de contrôle est une réponse au glucose, qui utilise la protéine activatrice des catabolites (CAP), pour augmenter considérablement la production de β-galactosidase en absence de glucose. L'adénosine monophosphate cyclique (AMPc) est une molécule signal dont la prévalence est inversement proportionnelle à celle du glucose. Il se lie à la CAP, qui permet à son tour au complexe formé de se lier au site de liaison CAP (une séquence d'ADN de 16 paires de bases en amont du promoteur), qui aide l'ARN polymérase à se lier à l'ADN. En absence de glucose, la concentration d'AMPc est élevée et la liaison de CAP-AMPc à l'ADN augmente de manière significative la production de β-galactosidase, permettant à la cellule d'hydrolyser le lactose et de libérer le galactose et le glucose.
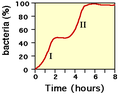
- Phénomène de diauxie
Diauxie signifie « deux croissances » en grec. La présence de l'opéron explique le phénomène de diauxie[1]. Une population bactérienne mise dans un milieu de culture minimum contenant deux sucres présente une courbe de croissance biphasique. Après une première phase de croissance exponentielle, la croissance s'arrête puis reprend à nouveau de façon exponentielle. Après avoir épuisé le premier sucre, la répression de l'opéron est levée et le second sucre peut être utilisé. La latence entre la phase I et II s'explique par le temps pris pour synthétiser les gènes de l'opéron.
Génétique du mécanisme, mutants
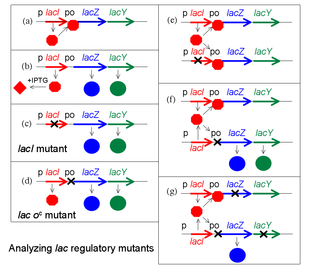
Une percée conceptuelle de François Jacob et Jacques Monod est de faire la distinction entre les substances régulatrices et les sites sur lesquels elles agissent pour changer l'expression des gènes. Jacob, ancien soldat, utilise l'analogie d'un bombardier qui largue sa cargaison mortelle lors de la réception d'une transmission radio spéciale ou d'un signal. Pour fonctionner ce système exige à la fois un émetteur au sol et un récepteur dans l'avion. Si l'émetteur est cassé, ce système peut fonctionner avec un deuxième émetteur fonctionnel. En revanche, dit-il, si l'on envisage un bombardier avec un récepteur défectueux, le comportement de ce bombardier ne peut pas être changé par l'introduction d'un deuxième avion fonctionnel[1].
Pour analyser les mutants de la régulation de l'opéron lac, Jacob a développé un système dans lequel une deuxième copie des gènes lac (lacI avec son promoteur, et lacZYA avec le promoteur et l'opérateur) pourrait être introduite dans une même cellule. Il teste alors le phénotype de la régulation d'une culture de ces bactéries, uniquement diploïdes pour les gènes lac. Cette expérience révèle en particulier que LacZ et LacY sont produits même en l'absence d'IPTG. Cette expérience, dont les gènes ou groupes de gènes sont testés par paires, est appelé un test de complémentation.
Analogues du lactose
Il existe de nombreux analogues ou dérivés du lactose permettant d'induire l'opéron lactose. Ces composés sont principalement des galactosides substitués, où le glucose du lactose est remplacé par un autre groupe chimique :
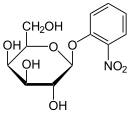
- l'isopropyl β-D-1-thiogalactopyranoside (IPTG) est l'un des plus utilisé, et joue le rôle d'inducteur de l'opéron lac. L'IPTG à la capacité de se lier au répresseur de l'opéron et ainsi permettre la synthèse de la β-galactosidase. Un avantage de l'IPTG pour des études in vivo, c'est que ne pouvant pas être métabolisé par E. coli sa concentration reste constante et que le taux d'expression des gènes controlés par lac p et lac o n'est pas une variable dans l'expérience. L'entrée de l'IPTG dépend de la perméase lactose (codée par lacY)[2].
- le phényl-β-D-galactose (Pgal) est un substrat pour la β-galactosidase, mais n'inactiver le répresseur et n'est donc pas un inducteur. Comme les cellules de type sauvage ne produisent que très peu de β-galactosidase, elles ne peuvent pas pousser sur le phényl-gal pour source de carbone et d'énergie. Les mutants n'ayant pas le répresseur sont capables de croître sur le phényl-gal. Ainsi, un milieu minimal contenant uniquement du phényl-gal comme source de carbone et d'énergie est sélectif pour les mutants au répresseur ou à l'opérateur non fonctionnels. Si 108 cellules d'une souche de type sauvage sont étalées sur des plaques d'agar contenant le phényl-gal, les colonies qui se développent sont essentiellement les rares mutants spontanés affectant le répresseur. La répartition relative des mutations affectant le répresseur et l'opérateur dépend de la taille des séquences en jeu : comme le gène lacI codant le répresseur est environ 50 fois plus grand que le gène de l'opérateur, les mutants sans répresseur prédominent dans la sélection.
- d'autres composés sont des indicateurs colorés de l'activité de la β-galactosidase :
- l'ONPG est clivé pour produire un composé d'un jaune intense, l'orthonitrophénol, et est couramment utilisé comme substrat pour le dosage de la β-galactosidase in vitro ;
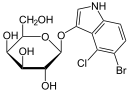
- l'X-gal (5-bromo-4-chloro-3-indolyl-β-D-galactoside) est un très bon substrat pour la β-galactosidase, mais est incapable d'en induire la production (en inhibant le répresseur). Dans les colonies produisant la β-galactosidase, l'X-gal est clivé avec d'un côté le galactose et de l'autre le noyau indole portant le chrome et le brome qui donne une couleur bleue aux dites colonies.
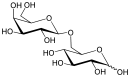
- l'allolactose (galactose-(β1→6)-glucose) est un isomère du lactose (galactose-(β1→4)-glucose) et l'inducteur de l'opéron lac. Le lactose est converti en allolactose par la β-galactosidase dans une réaction alternative à une hydrolyse. Une expérience physiologique démontrant que le rôle de la β-galactosidase (codée par lacZ) dans la production du « bon » inducteur dans les cellules d'E. coli consiste en l'observation qu'un mutant nul lacZ peut encore produire la perméase LacY lorsqu'il est cultivée en présence d'IPTG, mais pas lorsqu'il est cultivé avec du lactose. L'explication est que le passage du lactose à l'allolactose (catalysé par la β-galactosidase) est nécessaire pour produire l'inducteur à l'intérieur de la cellule.
Bibliographie
- (fr) Neil Campbell et Jane Reece (trad. René Lachaîne et Michel Bosset), Biologie, Pearson Education, 2007, 7e éd., 1488 p. (ISBN 978-2-7440-7223-9), « La génétique des Virus et des Procaryotes », p. 386-388
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Lac operon » (voir la liste des auteurs)
- [PDF] (en) François Jacob et Jacques Monod, « Genetic regulatory mechanisms in the synthesis of proteins », dans J. Mol. Biol., vol. 3, juin 1961, p. 318–356 [texte intégral, lien PMID, lien DOI]
- (en) Lars H. Hansen, Steen Knudsen et Søren J. Sørensen, « The effect of the lacY gene on the induction of IPTG inducible promoters, studied in Escherichia coli and Pseudomonas fluorescens », dans Current microbiology, vol. 36, no 6, juin 1998, p. 341–347 [lien PMID, lien DOI]
- Portail de la microbiologie
- Portail de la biologie cellulaire et moléculaire
- 3 gènes de structure :
Wikimedia Foundation. 2010.