- Neurogenèse
-
La neurogenèse désigne l'ensemble du processus de création d'un neurone fonctionnel du système nerveux. Elle peut également désigner, au sens large, la mise en place des principales structures du système nerveux au cours du développement mais on lui préfèrera alors le terme moins équivoque de neurodéveloppement. La formation du système nerveux commence durant le développement embryonnaire et ne s'achève entièrement que durant l'adolescence. Néanmoins, une neurogenèse localisée persiste par la suite chez l'adulte et pourrait jouer un rôle fonctionnel dans la plasticité neuronale du cerveau[1]
Sommaire
Mécanismes de formation d'un neurone
La neurogenèse ne décrit pas seulement la différenciation d'une cellule souche en cellules neuronales, elle désigne l'ensemble de la formation d'un neurone fonctionnel et intégré au sein du système nerveux. Elle comprend donc différentes étapes, schématiquement successives, mais qui se recouvrent en partie dans la réalité :
- Différenciation d'une cellule souche ou pluripotente en neuroblaste (cellule progénitrice des neurones)
- Migration du corps cellulaire vers la zone d'accueil prédéterminée (ex: couche cellulaire du cortex)
- Prolongement de l'axone vers sa structure cible
- Formation des dendrites et synaptogenèse
- Maturation : les neurones fonctionnels voient leurs synapses se renforcer et les neurones non utilisés sont éliminés (mécanisme d'élagage)
- Plasticité (modification constante des propriétés du neurone au cours de la vie adulte)
Neurogenèse embryonnaire
Durant la gastrulation, le feuillet ectodermique qui se situe à la surface de l'embryon reçoit, sur une partie de sa surface, des signaux provenant du mésoderme sous-jacent. Ses signaux induisent la différenciation d'une partie du tissu en neuro-ectoderme ; le reste de l'ectoderme, lui, deviendra de l'épiderme. Cette différenciation entre deux identités cellulaires différentes (ici, futur tissu nerveux ou futur tissu épidermique) repose sur des gradients de molécules sécrétées activatrices ou inhibitrices de la différenciation (notamment les BMP, Wnt et Shh). La formation de ces gradients de molécules antagonistes est un des mécanismes majoritaires permettant d'expliquer l'embryogenèse.
La surface induite en neuro-ectoderme s'appelle la plaque neurale. Durant l'étape suivante de neurulation, cette plaque va se refermer pour permettre la formation du tube neural. La fermeture s'effectue d'abord au niveau thoracique puis s'étend de part et d'autre. Elle est complète à 28 jours chez l'embryon humain.
Entre la 10e et la 20e semaine de gestation chez l'homme, survient la neurogenèse à proprement parler : des cellules souches situées dans le tube neural se multiplient et se différencient jusqu'à former un stock de 100 milliards de neurones ; ces nouveaux neurones s'assemblent ensuite en six couches superposées pour constituer le cortex cérébral lors de la migration opérée entre la 12ème et la 24ème semaine[2].
Découverte des cellules souches neurales adultes
Dès 1960, la formation de nouveaux neurones dans une partie de l'hippocampe avait été suspectée pendant la vie post-natale et chez le jeune adulte. En 1998, Elizabeth Gould de l'université de Princeton démontre la neurogenèse dans une partie spécifique de l'hippocampe du singe adulte. Ce même phénomène est observé par l'équipe de Freg Gage au Salk Institute de Californie chez l'être humain[3].
Les cellules souches neurales sont des cellules multipotentes, capables de se renouveler. En 1992, Reynolds et Weiss ont été les premiers à isoler des cellules souches et progénitrices neurales à partir du striatum, contenant la région sous-ventriculaire, de cerveaux de souris adultes[4]. Depuis, des cellules souches et progénitrices ont été isolées à partir d’autres régions du système nerveux centrale, dont la moelle épinière, à partir de différentes espèces dont l’homme[5],[6].
Le facteur de croissance épidermique (EGF) et le facteur de croissance fibroblastique (FGF) sont des facteurs de prolifération des cellules souches et progénitrices in vitro, mais d’autres facteurs synthétisés par les cellules souches et progénitrices en culture sont nécessaires pour leur expansion[7]. La neurogenèse dans le cerveau adulte se produirait à partir de cellules souches neurales. L’origine et l’identité de ces cellules restent à déterminer.
Neurogenèse adulte
Contrairement au dogme de la fixité neuronale formulé par Santiago Ramón y Cajal, de nouvelles cellules neuronales sont générées dans le système nerveux adulte chez la plupart des espèces (mammifères, oiseaux (canaris), poissons (poisson zèbre), cnidaires (éponge), insectes (grillon). La neurogenèse se déroule principalement dans deux régions du cerveau des mammifères adultes[5],[6], dont l’homme[8] :
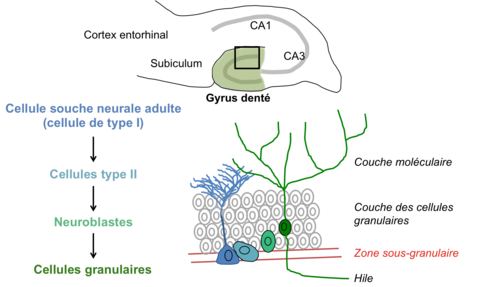
- Le gyrus denté de l’hippocampe
- La zone sous-ventriculaire, région située sous la paroi des ventricules latéraux
Neurogenèse hippocampique
Dans l'hippocampe, la neurogenèse adulte a lieu au niveau du gyrus denté et, plus précisément, au niveau de la zone sous-granulaire. Les cellules souches neurales (cellules de type I), qui résident et se maintiennent au cours de la vie adulte dans cette zone, produisent, par division asymétrique, des cellules progénitrices (cellules de type II). Celles-ci prolifèrent puis se différencient en neuroblastes et migrent dans la couche granulaire. Ces neuroblastes se différencient majoritairement en neurones excitateurs appelés cellules granulaire. Il est également suspecté que cette niche de cellules souches produisent également des interneurones du gyrus denté et quelques cellules gliales (olygodendrocytes ou astrocyte). Les nouveaux neurones subissent une intense sélection et ne deviennent matures et fonctionnels qu'une infime partie des neurones produits. Cela permet notamment de maintenir le volume du gyrus denté constant.
La raison fonctionnelle du maintien de cette niche dans l'hippocampe n'a pas encore été établie. Il est supposé que ce phénomène serait nécessaire aux mécanismes de mémorisation et de repérage spatial - deux des fonctions principales de l'hippocampe - chez l'adulte, en apportant un support pour coder de nouvelles informations et ainsi participer à la plasticité de cette structure.
Neurogenèse sous-ventriculaire
La neurogenèse sous-ventriculaire diffère sur certains points de la neurogenèse de l'hippocampe. les cellules souches neurales résident au sein d'une niche localisée dans la paroi des ventricules latéraux, la zone sous-ventriculaire (ZSV) ou zone sous-épendymale puisqu'elles se situent sous la couche des cellules épendymaires qui tapissent la paroi et constitue la barrière entre le liquide cérébro-spinal et le cerveau.
Les cellules souches neurales sont des cellules pseudo-gliales car elles présentent, de manière intrigante, plusieurs caractéristiques des astrocytes (ex: elles expriment le marqueur glial GFAP). Elles ont une morphologie étoilée comme les astrocytes. Elles ont un prolongement en contact direct avec le liquide cérébro-spinal et présente un unique cil à cet endroit appelé cil primaire, dont la fonction semble liée à la régulation de la neurogenèse. Enfin certains de leur prolongement sont en contact direct avec des vaisseaux sanguins qui irriguent cette zone et pourrait, là encore, intervenir dans la régulation de la neurogenèse.
Ces cellules, souvent appelées cellules B, engendrent des cellules progénitrices, les cellules C, qui sont des cellules qui prolifèrent transitoirement dans la niche. Celles-ci se différencient ensuite en neuroblastes ou cellules A. La niche neurogénique sous-ventriculaire est donc composée de trois types cellulaire (B, C et A) qui sont en contact étroit et communiquent pour réguler la neurogenèse (boucle d'auto-régulation).
Contrairement à la niche du gyrus denté, les neuroblastes ne restent pas au niveau de la ZSV et migrent hors de cette zone sous forme de chaîne. Les différentes chaines de neuroblastes se rejoignent au niveau du toit des ventricules et se dirigent vers la partie antérieure du cerveau où elles forment un flux de migration, appelé RMS (pour rostral migratory stream en anglais). Ce flux part de la ZSV et abouti dans le bulbe olfactif, structure la plus antérieure chez le rongeur et situé juste au dessus de la cavité nasale chez l'homme.
Dans le bulbe olfactif, les neuroblastes migrent radialement et s’intègrent dans différentes couches de cette structure où ils se différencient en interneurones. Deux types d'interneurones ont été principalement décrits : les neurones granulaires et les neurones périglomérulaires. Cette apport continu en nouveaux interneurones pourrait jouer un rôle dans le codage des nouvelles odeurs. Le volume du bulbe olfactif n'augmentant pas durant la vie adulte, il existe un mécanisme de sélection capable de supprimer les neurones non utilisés et de sélectionner parmi les nouveaux neurones seulement ceux qui s'intègrent durant le codage d'une nouvelle odeur.
Régulation de la neurogenèse adulte
La neurogenèse adulte est un système dynamique contrôlé par de multiples facteurs intrinsèques et extrinsèques. Elle est notamment régulée par :
- des facteurs de croissance (ex: FGF, EGF, BDGF, etc.),
- des neurotransmetteurs (ex: sérotonine, dopamine, glutamate, etc.),
- des hormones (ex: œstrogène, prolactine, corticostéroïdes),
- des médicaments (ex: antidépresseur, opiacé, lithium, etc.).
De nombreuses conditions de vie influent également sur la neurogenèse adulte, parmi lesquels on trouve le vieillissement, la grossesse, le stress, les maladies, l'activité physique, la richesse de l'environnement, la diète, l'apprentissage, etc. Les facteurs qui ont un effet (positif ou négatif) sur le nombre de nouveaux neurones produits sont susceptibles d'agir à n'importe quel niveau du processus, de la division de la cellule souche, jusqu'à la maturation du neurone. Cette complexité de la régulation commence à peine à être appréhendée[9].
Pathologies liées à la neurogenèse
La neurogenèse adulte est un mécanisme très récemment découvert qui génère beaucoup d'espoir pour le traitement de différentes pathologies. L'idée centrale consiste à être capable de rediriger la neurogenèse vers les sites de lésion et ainsi d'être capable de réparer avec les propres cellules du patient et avec un minimum d'intervention le manque de neurone.
Pathologies du développement
Pathologies adultes
Pathologies du vieillissement
Références
- Ming & Song, Adult neurogenesis in the Mammalian brain: significant answers and significant questions. Neuron 2011.
- Elena Sender, Dossier : les 5 âges du cerveau, Sciences et avenir, février 2010, page 46.
- Prévenir Alzheimer, Mireille Peyronnet, 2008, Editions Alpen, Monaco, ISBN 978-2-914923-86-6, p.39.
- Reynolds BA, Weiss S. (1992) Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. Mar 27;255(5052):1707-10. PMID: 1553558. [1]
- Taupin P, Gage FH. (2002) Adult neurogenesis and neural stem cells of the central nervous system in mammals. J Neurosci Res. Sep 15;69(6):745-9. PMID: 12205667. [2]
- Taupin P. Neurogenesis in the pathologies of the nervous system, Med Sci (Paris). 2005 Aug-Sep;21(8-9):711-4. PMID: 16115455. [3]
- Taupin P, Ray J, Fischer WH, Suhr ST, Hakansson K, Grubb A, Gage FH. (2000) FGF-2-responsive neural stem cell proliferation requires CCg, a novel autocrine/paracrine cofactor. Neuron. Nov;28(2):385-97. PMID: 11144350. [4]
- Eriksson PS, Perfilieva E, Bjork-Eriksson T, Alborn AM, Nordborg C, Peterson DA, Gage FH. Neurogenesis in the adult human hippocampus. Nat. Med. 1998 Nov;4(11):1313-7. PMID: 9809557. [5]
- JM Encinas, G Enikolopov, Identifying and Quantitating Neural Stem and Progenitor Cells in the Adult Brain. METHODS IN CELL BIOLOGY, VOL. 85, chap. 11, 2008.
Wikimedia Foundation. 2010.