- Anticorps Monoclonaux
-
Anticorps monoclonal
Les anticorps monoclonaux sont des anticorps reconnaissant le même épitope car ils sont issus d'une seule lignée de plasmocytes, provenant d'une seule cellule. Ils sont le produit d'une fusion entre un lymphocyte B et une cellule cancéreuse (myélome).
Sommaire
Histoire
Durant les années 1970, il était connu qu'un cancer (myélome) des cellules B produisait de grandes quantités d'anticorps identiques. En 1975, Georges Köhler et César Milstein[1],[2] ont publié dans Nature une technique de production d'anticorps monoclonaux. En 1984, ils ont reçu le prix Nobel de médecine pour cette découverte. En 1988, Greg Winter a établi les premières techniques d'humanisation des anticorps monoclonaux, pavant la voie à leur utilisation médicale[3].
- 1975: mise au point de la technique d’obtention des anticorps monoclonaux (Kohler et Milstein, Nature)
- 1984: Ac monoclonaux chimériques souris/homme
- 1986: premier Ac monoclonal mis sur le marché: Muromomab (anti-CD3)
- 1989: Ac monoclonaux humanisés
- 1994: production d’Ac monoclonaux humains par des souris transgéniques ou trans-chromosomiques
Principe
Afin de produire des lignées stables de cellules produisant l'anticorps désiré, Kohler et Milstein ont élaboré l'idée et la méthode de fusion de deux types de cellules. Ainsi, des cellules B (produisant les anticorps), dont l'incapacité de se reproduire est palliée par des myélomes (des cellules cancéreuses immortelles) résulte en un hybridome secrétant des anticorps et ayant à la fois la propriété de se reproduire indéfiniment.
Production
Plusieurs étapes sont nécessaires pour l'obtention d'anticorps monoclonaux.
- Immunisation
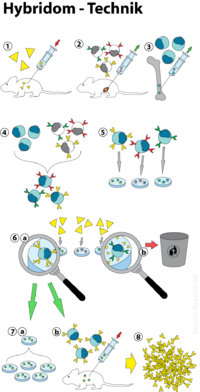
La première est une inoculation (1), généralement par voie péritonéale d'un antigène ou d'un haptène à un animal de laboratoire, (souvent un rongeur, les plus courants étant la souris, le rat ou le lapin), ce qui a pour effet de produire des plasmocytes libérant des anticorps contre cet antigène. Des anticorps différents (polyclonaux) sont produits pour combattre l'antigène. Il est possible d'obtenir des anticorps reconnaissant des substances qui ne sont pas immunogéniques, en les conjuguant à des protéines immunogéniques, comme la BSA, le KLH ou le DNP. Plusieurs protocoles d'immunisation sont possibles en variant les doses, les intervalles des injections, l'adjuvant utilisé et la durée du traitement. L'adjuvant utilisé est principalement l'adjudant de Freund soit incomplet (émulsion d’huiles, d’eau et d’émulsifiants (savons) qui piège l’Ag) soit complet (complexe d’eau, d’huiles, d’émulsifiants et de morceaux de bactéries tuées). Cette injection a pour effet de produire des plasmocytes libérant des anticorps polyclonaux contre cet antigène. Les adjuvants agissent selon 2 types d’actions dans préparations vaccinales. Le premier favorise et prolonge la durée de l’interaction entre l’antigène et le système immunitaire par exemple l’hydroxyde d’alumine. Le second recrute et active les cellules de l’immunité naturelle pour qu’elles induisent la réponse adaptative.
- Fusion
Ensuite, l'animal est sacrifié et les cellules B sont isolées à partir de la rate (2). Celles-ci, ne pouvant se multiplier mais produisant les anticorps désirés, sont fusionnés (4) avec des myélomes (cellules cancéreuses, donc aptes à une division cellulaire rapide et immortelles). Cette étape de fusion peut être effectuée en utilisant le PEG ou par électroporation. Ces cellules sont ensuite mises en culture, ces hybridomes ayant la propriété des cellules cancéreuses, elles se multiplient rapidement et indéfiniment.
- Propagation, sélection et clonage
Les cellules myélomateuses utilisées pour la fusion ne produisent pas d'anticorps ou une des chaînes d'anticorps. De plus, ces cellules ont perdu (par sélection génétique) la faculté de produire une enzyme appelée hypoxanthine-guanine phosphoribosyltransferase (HGPRT). Cette enzyme est impliquée dans la synthèse des nucléotides, plus particulièrement dans la voie de sauvetage (par opposition à la voie de novo). La sélection des cellules fusionnées se fait avec les composés chimiques hypoxanthine, aminoptérine et thymidine (HAT) L'aminoptérine, en bloquant la synthèse de novo des nucléotides, oblige les cellules à utiliser la voie de sauvetage. Les myélomes parents n'ayant pas l'enzyme essentielle, seules les cellules fusionnées avec les splénocytes et l'ayant ainsi acquis pourront survivre. L'hypoxanthine et la thymidine sont les substrats de cette voie de sauvetage. Par ailleurs, les cellules B non-fusionnées s'élimineront d'elles-mêmes, étant incapable de se reproduire. Suite à une période de sélection dans le milieu HAT, les hybridomes se développent en colonies. Le taux de succès d'une fusion est plutôt faible et varie selon le protocole utilisé (de 5% à 50% [réf. nécessaire]). Afin de favoriser la croissance de ces hybridomes, plusieurs additifs peuvent être ajoutés dans le milieu de culture (FBS, facteur de croissance, couche de cellules nourricières). Ces lignées d'hybridomes secrètent des anticorps tous différents. Afin de sélectionner notre anticorps d'intérêt, il faut d'abord isoler chacun des clones (5). Classiquement, cette sélection se fait par dilution limite pour permettre l'isolation de clones uniques. Plus récemment, l'utilisation du cytomètre en flux permet aussi la séparation de cellules. Après une seconde ronde de culture, chaque clone est ensuite testé, la plupart du temps en Western Blot, par ELISA ou par RIA, afin de vérifier sa capacité à lier l'antigène ou l'haptène utilisé pour l'immunisation. Les anticorps sécrétés sont ensuite testés pour éliminer ceux qui induisent des réactions croisées avec d'autres antigènes.
- Production
Après la sélection, la production de lots d'anticorps se fait par purification d'un milieu biologique contenant l'anticorps en solution, celui-ci étant soit un ascite produit chez l'animal (c’est-à-dire une injection intrapéritonéale de l'hybridome dans un animal préparé à l'avance) (7b), soit un surnageant de culture cellulaire ayant servi à cultiver l'hybridome in vitro (7a). Selon l'échelle de grandeur désirée, la production en suspension cellulaire peut se faire dans des bioréacteurs. La purification proprement dite peut se faire de différentes manières, comme par exemple la chromatographie liquide haute performance, par affinité avec la protéine G ou par précipitation à l'ammonium.
Une fois obtenu un clone d'hybridome sécrétant un anticorps de spécificité voulue, il sera caractérisé afin de connaître la classe des chaînes d'immunoglobine, son affinité, ou l'épitope reconnu (epitope mapping). Il est possible de déterminer la séquence d'ADN du gène des immunoglobulines de ce clone, de le sous-cloner et de le modifier. Ceci permet de produire des anticorps chimériques ou humanisés, ou encore de produire uniquement le fragment de l'anticorps Fab reconnaissant l'antigène.
Utilisation
Les applications varient de l'usage en laboratoire à l'application clinique. Les anticorps monoclonaux ont de multiples applications en recherche et en diagnostic, clinique humaine et animale, exploitant la reconnaissance de protéines en biologie, ou encore être utilisés comme médicaments (quelques exemples).
Références
- ↑ Kohler G, Milstein C., (1975) Continuous cultures of fused cells secreting antibody of predefined specificity. Nature. (5517):495-7.
- ↑ Disponible gratuitement dans le The Journal of Immunology
- ↑ Riechmann L, Clark M, Waldmann H, Winter G. (1988) Reshaping human antibodies for therapy. Nature 332:323-7.
- Portail de la biologie
Catégories : Anticorps | Technique basée sur un principe immunologique
Wikimedia Foundation. 2010.