- Ladderane
-
Ladderane 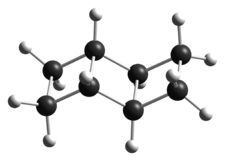
Structure du ladderane C8H12Général Nom IUPAC Ladderane Propriétés chimiques Formule brute C2n+2H2n+6 Composés apparentés Autres composés Cyclobutane Unités du SI & CNTP, sauf indication contraire. Un ladderane est un hydrocarbure de formule générale C2n+2H2n+6 avec n ≥ 3 et contenant deux ou plusieurs cycles cyclobutane fusionnés. Les molécules de cette famille n'ont que des liaisons simples. Les cycles fusionnés à quatre atomes de carbone font ressembler la molécule à une échelle, d'où le nom de cette famille de composés. Ils peuvent être formés par réduction d'une double-liaison carbone-carbone en liaison simple avec formation concomitante d'une liaison carbone-carbone fermant un cycle cyclobutane[1],[2].
La géométrie des ladderanes est très contrainte car les ligands sur les atomes de carbone ne peuvent pas se positionner dans l'angle de liaison naturel.
Astronautique
Les hydrocarbures saturés polycycliques ressemblant plus ou moins étroitement au ladderane C12H16 sont les espèces moléculaires les plus performantes du RP-1, un combustible stockable américain formant, avec l'oxygène liquide, un propergol liquide utilisé depuis les années 1950 par un très grand nombre de lanceurs jusqu'à nos jours :
- Ces molécules sont saturées et ne polymérisent donc pas à haute température, évitant la formation de dépôts solides le long des conduits de refroidissement du moteur-fusée
- Ces molécules ne se dissocient pas en fractions plus légères à haute température, évitant la formation de bulles s'accumulant sur les dépôts solides de carburant polymérisé et risquant d'obstruer les conduits.
Biochimie
De façon totalement inattendue, des lipides à chaîne latérale de type ladderane ont été trouvés dans des organismes vivants[1], notamment l'acide pentacycloanammoxique[3] dont le nom vient de ce qu'il a été trouvé dans des bactéries réalisant le processus d'anammox (oxydation anaérobie de l'ammonium) à 90 m sous la surface de la mer Noire. On pense que cet acide gras permet la formation d'une membrane dense et robuste capable de protéger ces organismes de l'effet toxique de l'hydroxylamine NH2OH et de l'hydrazine N2H4 produites lors de production de diazote N2 et d'eau H2O à partir de l'ion nitrite NO2– et de l'ammoniac NH3[4].
Notes et références
- Nouri, D H, Tantillo, D J, « They Came from the Deep: Syntheses, Applications, and Biology of Ladderanes », dans Curr. Org. Chem., vol. 10, 2006, p. 2055–2074 [lien DOI]
- Nouri, D H et Tantillo, D J. "Ladderane Formation Mechanisms: The Uphill Battle". 232nd American Chemical Society National Meeting, San Francisco, CA, 10-14 septembre 2006: COMP 247.
- J. S. Sinninghe Damsté, M. Strous, W. I. C. Rijpstra, E. C. Hopmans, J. A. J. Geenevasen, A. C. T. van Duin, L. A. van Niftrik et M. S. M. Jetten, « Linearly concatenated cyclobutane lipids form a dense bacterial membrane », dans Nature, vol. 419, 2002, p. 708–712 [lien DOI]
- Vincent Mascitti et E. J. Corey, « Enantioselective Synthesis of Pentacycloanammoxic Acid », dans J. Am. Chem. Soc., vol. 128, no 10, 2006, p. 3118 [lien DOI]
Wikimedia Foundation. 2010.
