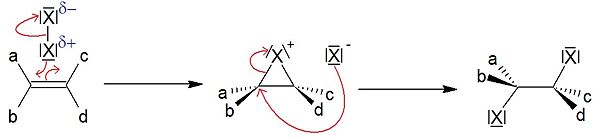- Halogénation
-
L'halogénation est une réaction chimique qui permet d'introduire un ou plusieurs atomes d'halogène dans une réaction. En fonction de l'élément impliqué, on parle de fluoration, chloration, bromation ou d'iodation. Les halogènes ayant des propriétés similaires, ces réactions sont assez semblables.
Il existe plusieurs réactions d'halogénation différentes:
- l'addition radicalaire
- la substitution radicalaire
- l'halogénation des cétones
- l'addition électrophile des halogènes sur les alcènes ou alcynes (dihalogénation et hydrohalogénation)
- la substitution électrophile aromatique sur les noyaux aromatiques
Sommaire
Addition électrophile
Dihalogénation
Il s'agit de l'addition d'un dihalogène sur l'alcène.
Exemple de la dibromation : le mécanisme de bromation des alcènes peut se décrire comme suit. Les électrons π de la double liaison attaquent un brome rendu électrophile lors de l'approche des réactifs entre eux (le brome étant assez volumineux, il est d'autant plus polarisable), ce qui provoque la rupture de la liaison brome-brome et la formation d'un intermédiaire bromonium (ion ponté chargé +) accompagné d'un ion bromure (chargé -).
L'ion ponté est peu stable, en effet le cycle à 3 (2 carbones et le brome) donnent des angles très faibles et il y a beaucoup de répulsion électronique au niveau des liaisons covalentes. Le brome de l'ion ponté portant la charge +, il exerce de forts effets inductifs sur les 2 carbones du cycle qui deviennent électrophiles.
Au contraire, l'ion bromure (Br-) est nucléophile (car chargé négativement). Il attaque alors l'un des deux carbones et le doublet liant constituant la liaison C-Br, plus faible que la liaison C-C, se replie sur le brome. On obtient ainsi le dibromoalcane, produit final de la réaction. Cette réaction entropiquement défavorable (on diminue le désordre en formant une seule molécule à partir de deux) est enthalpiquement favorable (on forme deux liaisons C-Br aux dépens d'une liaison π C=C).
Ce mécanisme d'addition sur un alcène est donc anti (l'ion bromure va obligatoirement attaquer du côté opposé au pont bromonium, à cause de l'encombrement stérique). La réaction est stéréospécifique anti (elle est donc également stéréoselective).La première étape est cinétiquement déterminante.
Dans le cas du chlore on a aussi une addition mais qui ne passe pas par un pont chloronium. Dans ce cas, on n'a donc aucune stéréoselectivité. Cette réaction ne peut se produire avec le diiode (thermodynamiquement impossible), ni avec le difluor (réaction trop violente).
Hydrohalogénation
Il s'agit cette fois-ci de l'addition d'un halogénure d'hydrogène (H-X). L'halogène étant plus électronégatif que l'hydrogène, il va induire sur celui-ci une charge partielle positive ce qui fait de lui un électrophile, qui va alors s'additionner sur l'alcène (formation d'une liaison C-H), provoquant la rupture du doublet liant partagé entre l'hydrogène et l'halogène qui est récupéré par ce dernier.
L'halogénure obtenu s'additionne sur le carbocation formé donnant ainsi l'halogeno-alcane.
La première étape est cinétiquement déterminante.
Si les réactifs de départs sont disymétriques, il y a régiosélectivité. Le produit majoritaire est celui qui est issu du carbocation qui s'est formé le plus rapidement à la 1re étape, c'est en général le carbocation le plus stable. (cf. règle de Markovnikov)
Addition radicalaire
Article détaillé : Halogénation radicalaire.Substitutions radicalaire
Article détaillé : Halogénation radicalaire.Catégories :- Réaction de substitution
- Réaction d'addition
- Réaction inorganique
Wikimedia Foundation. 2010.