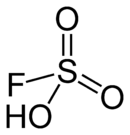
HSO3F
- HSO3F
-
Acide fluorosulfurique
| Acide fluorosulfurique |
|
  |
| Général |
| Nom IUPAC |
Acide fluorosulfurique |
| No CAS |
7789-21-1 |
| No EINECS |
232-149-4 |
| Apparence |
liquide incolore |
| Propriétés chimiques |
| Formule brute |
HFO3SHSO3F |
| Masse molaire |
100,07 g∙mol-1
H 1,01 %, F 18,99 %, O 47,96 %, S 32,04 %,
|
| pKa |
-10 |
| Propriétés physiques |
| T° fusion |
-87,3 °C |
| T° ébullition |
165,5 °C |
| Solubilité |
Soluble dans l'eau |
| Masse volumique |
1,84 , liquide |
| Précautions |
|
Directive 67/548/EEC
|

C
|
|
Numéro index :
016-018-00-7
Symboles :
C : Corrosif
Phrases R :
R20 : Nocif par inhalation.
R35 : Provoque de graves brûlures.
Phrases S :
S26 : En cas de contact avec les yeux, laver immédiatement et abondamment avec de l’ eau et consulter un spécialiste.
S45 : En cas d’ accident ou de malaise, consulter immédiatement un médecin ( si possible, lui montrer l’ étiquette).
(S1/2) : Conserver sous clef et hors de portée des enfants.
|
| Phrases R : 20, 35, |
| Phrases S : (1/2), 26, 45, |
|
SIMDUT[1]
|
  E, F,
E, F,
E : Matière corrosive
Transport des marchandises dangereuses : classe 8
F : Matière dangereusement réactive
réagit violemment au contact de l'eau en dégageant un gaz très toxique : chlorure d'hydrogène
Divulgation à 1,0% selon la liste de divulgation des ingrédients
|
|
SGH[2]
|

Danger
H314, H332,
H314 : Provoque de graves brûlures de la peau et des lésions oculaires
H332 : Nocif par inhalation
|
|
Unités du SI & CNTP, sauf indication contraire.
|
L'acide fluorosulfurique est une molécule de formule HSO3F. C'est un des acides les plus forts que l'on connaisse.
Description
L'acide fluorosulfurique peut être vu comme une molécule d'acide sulfurique où un groupe -OH aurait été substitué par un atome de fluor. L'électronégativité du fluor supérieure à celle de l'oxygène entraîne une augmentation de l'acidité du produit obtenu.
Préparation
Il suffit d'ajouter du fluorure d'hydrogène (HF) à du trioxyde de soufre appelé aussi anhydride sulfurique (SO3)
Utilisation
On s'en sert quand on a besoin d'acidité très élevée, pour stabiliser les carbocations par exemple.
Notes et références de l'article
Voir aussi
Articles connexes
Liens et documents externes
 Portail de la chimie
Portail de la chimie
Catégories : Composé du fluor | Produit chimique corrosif | Composé du soufre | Superacide
Wikimedia Foundation.
2010.
Contenu soumis à la licence CC-BY-SA. Source : Article HSO3F de Wikipédia en français (auteurs)
Regardez d'autres dictionnaires:
HSO3F — Strukturformel Allgemeines Name Fluorsulfonsäure Andere Namen Fluorschwefelsäure Schwefelsäur … Deutsch Wikipedia
Supersäure — Supersäuren[1][2][3][4] sind Säuren, die stärker sind als konzentrierte (100 prozentige) Schwefelsäure (H2SO4)[5]. Somit haben alle Supersäuren einen pKs Wert im negativen Bereich. Zur Quantifizierung der Säurestärke verwendet man die Hammettsche … Deutsch Wikipedia
Magic acid — Fluorosulfuric acid antimony pentafluoride 1:1 Other names Magic Acid … Wikipedia
Fluorsulfonsäure — Strukturformel Allgemeines Name Fluorsulfonsäure Andere Namen … Deutsch Wikipedia
Supersäuren — Supersäuren[1][2][3][4] sind Säuren, die stärker sind als konzentrierte (100 prozentige) Schwefelsäure (H2SO4) pKs Wert = −3,9.[5] Somit haben alle Supersäuren einen pKs Wert im negativen Bereich. Zur Quantifizierung der Säurestärke verwendet man … Deutsch Wikipedia
КИСЛОТЫ НЕОРГАНИЧЕСКИЕ — неорг. в ва, молекулы к рых при электролитич. диссоциации в водной среде отщепляют протоны, в результате чего в р ре образуются гидроксоний катионы Н 3 О + и анионы кислотных остатков А : НА+Н 2 ОDН 3 О ++А (1) Исключение составляет борная к та… … Химическая энциклопедия
Суперкислота — Эта статья или раздел нуждается в переработке. Пожалуйста, улучшите статью в соответствии с правилами написания статей. Суперкислота (или сверхкислота … Википедия
Кислотные гидроксиды — Неорганические кислоты неорганические вещества, молекулы которых при электролитической диссоциации в водной среде отщепляют протоны, в результате чего в растворе образуются гидроксоний катионы Н3О+ и анионы кислотных остатков А: НА + Н2O ↔ Н3О+… … Википедия
Acidity function — An acidity function is a measure of the acidity of a medium or solvent system, [IUPAC Commission on Physical Organic Chemistry (1994). [http://www.iupac.org/publications/pac/1994/pdf/6605x1077.pdf Glossary of Terms used in Physical Organic… … Wikipedia
Hammettsche Aciditätsfunktion — Zur Quantifizierung der Säurestärke von Supersäuren führten Louis P. Hammett und Alden J. Deyrup 1932 die so genannte Hammett Funktion H0 ein,[1] da die pH Skala nach Sørensen nur für verdünnte Lösungen geeignet und durch die… … Deutsch Wikipedia






