- H3O+
-
Ion hydronium
L'ion hydronium (H3O+) est un ion oxonium. On trouve cet ion oxonium à l'état non hydraté dans des substances solides, dans des composés cristallins ou non. En revanche l'ion hydronium n'existe qu'en solution aqueuse. Il est alors entouré de plusieurs molécules d'eau (H2O) en nombre indéterminé (ce qui n'en fait donc pas rigoureusement un complexe) avec lesquelles il entretient des liaisons hydrogène.
Définitions
H+ : proton, mais éventuellement tritium et deutérium.
H3O+ : ion oxonium existant dans l'état solide; véritable complexe avec liaisons O-H dirigées.
H3O+(aq) abrégé de H3O+, n H2O: ion hydronium existant en milieu aqueux ; c'est un ion oxonium hydraté, entouré de façon informelle, par plusieurs couches de molécules d'eau (environ neuf couches). Les molécules d'eau polaires sont agglutinées autour de l'ion oxonium chargé positivement, sous l'influence de forces électrostatiques faibles. Ce phénomène appelé solvatation ou interaction du solvant s'appelle hydratation dans l'eau.
Eau solvant
L'ion hydronium est présent en permanence dans l'eau, du fait de la réaction d'autoprotolyse :
Tout d'abord il y a dissociation d'une molécule d'eau.
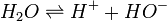 .
.Puis une deuxième molécule d'eau donne un véritable complexe avec le proton obtenu.
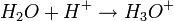
Enfin, l'ion oxonium s'entoure de plusieurs couches de molécules d'eau par le phénomène de solvatation (intervention du solvant: hydratation dans ce cas) sous l'influence de forces électrostatiques faibles (force de van der Waals) appelées encore ici, liaisons hydrogène. Le proton solvaté obtenu est appelé ion hydronium, noté H3O+(aq), abrégé de aqueux pour illustrer le fait qu'il est hydraté.
Le schéma réactionnel global peut s'écrire: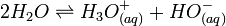
HO-(aq) étant l'ion hydroxyde qui est lui aussi soumis au phénomène de solvatation.
Néanmoins cette réaction est peu importante puisque dans 1 litre d'eau pure, à 25 °C, seulement 10-7 mole d'eau est dissociée, soit environ deux molécules sur un milliard...
L'ion hydronium est responsable de la propriété des acides selon la définition de Bronsted. Il est présent dans toute solution aqueuse en équilibre avec l'ion hydroxyde HO-. C'est la mesure de sa concentration qui permet de déterminer le pH de la solution.
- Portail de la chimie
Catégories : Cation | Acide | Composé de l'hydrogène
Wikimedia Foundation. 2010.
