- Glaces
-
Glace
 Pour les articles homonymes, voir Glace (homonymie).
Pour les articles homonymes, voir Glace (homonymie).La glace est de l'eau à l'état solide.
À la pression atmosphérique normale (101 325 Pa), l'eau est sous forme de glace lorsque sa température est inférieure à sa température de fusion qui est, par convention, de 0 °C (soit 273,15 K).
Cependant, en l'absence de cristal de glace, de l'eau calme peut être refroidie à des températures inférieures à 0 °C sans se congeler, dans un état d'équilibre instable appelé surfusion, et atteindre ainsi des températures allant jusqu'à -20 °C.
La température de fusion de la glace servit de point fixe pour la définition originelle de l'échelle de températures Celsius.
Sommaire
Physique de la glace
La glace présente plus de onze variétés allotropiques dont les domaines d'existence sont représentés dans le diagramme de phase ci-après. Elle existe également sous forme amorphe.
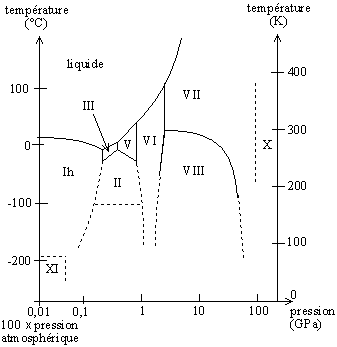 Diagramme de phase de la glace — pressions (1GPa = 10 000 bars) en échelle logarithmique
Diagramme de phase de la glace — pressions (1GPa = 10 000 bars) en échelle logarithmique
À la pression atmosphérique normale (et jusqu'à une pression d'environ 0,2 GPa ou 2 000 bars), les molécules d'eau de la glace ordinaire forment une structure cristalline suivant un réseau hexagonal (a = 4,52 Å, c = 7,37 Å), dont la stabilité est assurée par des liaisons hydrogène ; cette variété allotropique est appelée « glace 1h » ou « glace Ih » (h pour hexagonal). Cette structure présente une faible compacité, et la densité de la glace ordinaire est inférieure à celle de l'eau (917 kg/m³ pour de la glace pure à 0 °C, pression atmosphérique normale).
Ceci explique que la température du point de fusion de la glace ordinaire s'abaisse avec l'augmentation de la pression (il s'agit d'une anomalie : les températures de fusion croissent normalement avec la pression) jusqu'à un minimum de -22 °C (cf diagramme de phase de la glace) pour une pression d'environ 0,2 GPa (ici commence le domaine de la glace III).
En fonction des conditions de température et de pression, la glace peut adopter d'autres structures cristallines, généralement plus compactes que la glace ordinaire ; certaines de ces variétés de glace peuvent se rencontrer dans les conditions extrêmes régnant à la surface d'autres planètes ou satellites du système solaire :
- (basse température, cubique à faces centrées, densité : env. 0,9) ;
- glace II (basse température, orthorhombique centrée, densité : env. 1,2) ;
- glace III (basse température, tétragonal, densité : env. 1,1) ;
- glace IV (basse température, densité : 1,29) ;
- glace V (haute pression, basse température, monoclinique à base centrée, densité : env. 1,2) ;
- glace VI (haute pression, basse température, tétragonale, densité : env. 1,3) ;
- glace VII (haute température, haute pression, cubique simple, densité : env. 1,7) ;
- glace VIII (haute pression, tétragonale centré, densité : env. 1,6) ;
- glace IX (haute pression, tétragonale, densité : env. 1,2) ;
- glace X (haute pression, cubique centré) ;
- glace XI ;
- glace XII (haute pression, basse température, tétragonale, densité : env. 1,3) ;
- glace XIII (obtenue à 130 K et 0,5 GPa) ;
- glace XIV (obtenue à 118K et 1,2 GPa).
Propriétés physiques de la glace ordinaire (Ih)
 Bloc de calcaire fracturé par le gel de l'eau incluse dans la roche microporeuse, ici photographié deux ans après l'exposition du bloc au gel, dans le nord de la France. Le gel participe ainsi aux processus d'érosion, mais aussi de production de sol par délitement de la roche.
Bloc de calcaire fracturé par le gel de l'eau incluse dans la roche microporeuse, ici photographié deux ans après l'exposition du bloc au gel, dans le nord de la France. Le gel participe ainsi aux processus d'érosion, mais aussi de production de sol par délitement de la roche.
La masse volumique de la glace est de 917 kg/m³ à 0 °C, et son coefficient de dilatation linéaire est d'environ 9·10− 5/K, toujours à 0 °C.
Propriétés mécaniques
Le coefficient de dilatation linéaire de la glace est d'environ 9·10− 5/K à 0 °C. La compressibilité de la glace est de l'ordre de 12·10− 12/Pa.
La limite d'élasticité de la glace varie énormément suivant la qualité de la glace utilisée : 10 kPa pour la glace de glacier, 60 kPa pour de la glace artificielle.
Les valeurs admises pour le module d'Young de la glace se situent environ à 9.33 GPa (V.F. Petrenko, Physics of Ice)
Sa limite de plasticité est de 3,5 MPa (en compression) ; le rapport limite de plasticité/limite d'élasticité de la glace se range parmi les plus grands de tous les solides connus (environ 2 pour l'acier, et jusqu'à 10 pour le fer doux).
Une formule empirique permet de déterminer la pression supportable par une couche de glace ; si l'on considère H l'épaisseur de glace en centimètres, alors 4·H² donnera le nombre de kg par m² que la couche pourra supporter sans se briser.
Propriétés thermiques
À 0 °C, la chaleur latente de fusion de la glace est de 333 kJ·kg− 1 et sa capacité thermique massique est de 2,06 kJ·kg− 1·K− 1 ; celle-ci n'est que la moitié de la capacité thermique massique de l'eau à 0 °C (4,217 kJ·kg− 1·K− 1), et varie de façon quasi linéaire en fonction de la température (+ 0,17 %/K).
La conductivité thermique de la glace est de 2,1 W·m− 1·K− 1 à 0 °C, et augmente avec l'abaissement de la température (pente de l'ordre de − 0,57 %/K) ; elle est donc toujours bien supérieure à la conductivité thermique de l'eau à 0 °C, égale à 0,55 W·m− 1·K− 1.
Glace à température ambiante
En 2005, l'équipe coréenne de Heon Kang, de l'université de Séoul, a pu obtenir une glace d'eau à température ambiante (20 °C). Pour ce faire, un champ électrique est appliqué entre la pointe d'un microscope à effet tunnel et une surface d'or, où est disposé un film d'eau liquide, d'une épaisseur de l'ordre du nanomètre.
Dans cette expérience, l'eau se transforme en glace car les dipôles électrostatiques des molécules d'eau s'alignent sur le champ électrique. L'intensité du champ électrique à laquelle ce changement apparait (106 V·m− 1) est mille fois moins importante que ce que les modèles prédisaient.
Malgré la très faible épaisseur de la couche d'eau utilisée, ce phénomène pourrait, d'après les auteurs, intervenir au sein de nuages d'orages ou de microfissures de roches, ainsi que dans des équipements nanotechnologiques.
Mélanges
Fusion eutectique
En hiver, les routes sont salées pour faire fondre la glace. En fait, ce n'est pas la glace qui fond, mais un eutectique glace-sel.
Lorsque le sel NaCl (Na+, Cl−) entre en contact avec la glace, les ions s'arrangent autour des molécules d'eau, qui sont polaires (H2δ+, Oδ−) et viennent former un composé (H2O) (NaCl) ; ce réarrangement nécessite seulement de petits mouvements des atomes, et se fait donc en phase solide. Lorsque les proportions exactes sont respectées (soit environ 22 % de sel en masse), le mélange se conduit comme un produit pur, qualifié d'« eutectique ». La température de fusion de cet eutectique H2O-NaCl est d'environ -21,6 °C.
Le diagramme de phase suivant représente la température de fusion du mélange en fonction de la proportion eau-sel.
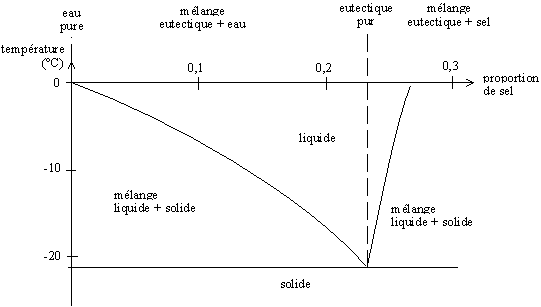 Diagramme de phase eau-sel à pression atmosphérique ; l'eutectique se forme pour une proportion de sel de 0,233 1 en masse (23,31 % de sel et 76,69 % d'eau en masse)
Diagramme de phase eau-sel à pression atmosphérique ; l'eutectique se forme pour une proportion de sel de 0,233 1 en masse (23,31 % de sel et 76,69 % d'eau en masse)
Ainsi, pour des taux de sel inférieurs à la proportion de l'eutectique, nous obtenons un mélange eau + eutectique qui fond à une température supérieure à -21,6 °C. Pour des taux de sel supérieurs à cette proportion, nous obtenons un mélange sel + eutectique qui fond également à une plus grande température.
Le réarrangement eau + sel → eutectique ne peut se faire qu'aux points de contact entre les cristaux de glace et de sel, donc à la surface de la glace. On a donc formation d'une couche superficielle d'eutectique qui fond (si la température est supérieure à -21,6 °C) ; comme le sel est en sursaturation, il se dissout dans l'eutectique fondu, et peut réagir avec la glace qui se trouve sous la pellicule liquide. Le phénomène se propage donc, jusqu'à ce qu'il manque de l'eau ou du sel pour former un nouvel eutectique.
En théorie, il serait donc possible de prévenir la formation de glace jusqu'à -21,6 °C. Dans les faits, il est impossible de doser la quantité de sel à mettre.
Histoire
Les plus vieilles bâtisses que l'on connait ayant servi à conserver la glace datent d'il y a 4 000 ans et se trouvent en Mésopotamie. Ce sont des constructions en terre de forme conique inversée.
Laboratoire
Quelques laboratoires étudient spécifiquement la glace :
- L'Antiicing Material International Laboratory (AMIL)[1],
- ainsi que le laboratoire de glaciologie et de géophysique de l'environnement à Grenoble[2].
Autres acceptions
Le mot glace désigne également :
- l'état solide du dioxyde de carbone, sous l'expression glace carbonique ou glace sèche.
Et par extension, les états solides des corps moléculaires qui comme l'eau forment un solide relativement transparent depuis les températures « usuelles » jusque vers le zéro absolu.
En astrophysique, on parle de glaces « exotiques » comme celles du méthane, de l'ammoniac ou de l'azote.
Mais aussi dans le langage courant :
- un miroir ;
- une crème glacée ;
- une pièce de distribution de fluide de certaines pompes ou certains moteurs hydrauliques en construction mécanique.
Notes et références
Voir aussi
Bibliographie
- Eun-Mi Choi, Young-Hwan Yoon, Sangyoub Lee, Heon Kang, Freezing Transition of Interfacial Water at Room Temperature under Electric Fields, Physical Review Letters, n°95, août 2005.
Articles connexes
- Eau
- Dans le Wikilivre de Tribologie, des données concernant le Frottement sur la glace
- Production du froid
- Banquise
- Glacier
- Iceberg
- Neige
- Verglas
- Glaçon
- Givre
Liens externes
- Quelques aspects de la physique de la glace, CNRS, dossier « Découvrir l'eau ».
- Portail de la chimie
- Portail de l’eau
Catégories : Eau à l'état solide | Réfrigération
Wikimedia Foundation. 2010.




