- Formule de nernst
-
Équation de Nernst
En électrochimie, l'équation de Nernst donne la tension d'équilibre (E) de l'électrode par rapport au potentiel standard (E0) du couple redox mis en jeu. Elle n'a de sens que si un seul couple redox est présent en solution (l'équation de Nernst ne s'applique donc pas aux potentiels mixtes) et que si les deux espèces de ce couple sont présentes.
Sommaire
Présentation de l'équation
Soit la demi-réaction suivante :
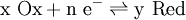
Pour celle-ci, l'équation de Nernst s'écrit :
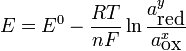
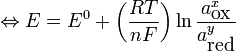
Or, à température ambiante (25 °C = 298,15 K), on a la relation suivante :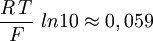
C'est pourquoi, pour peu qu'on assimile également les activités chimiques aux concentrations, on trouve souvent la relation suivante :![E = E^0 - \frac{0,059}{n} \log\frac{[\mbox{red}]^y}{[\mbox{ox}]^x}](/pictures/frwiki/102/f1dc1e85a2e8c660176c249d7ddfaf01.png) à 25 °C
à 25 °C![\Leftrightarrow E = E^0 + \frac{0,059}{n} \log\frac{[\mbox{ox}]^x}{[\mbox{red}]^y}](/pictures/frwiki/51/3321abbedab06e69d1c6eccdef13e0fb.png) à 25 °C
à 25 °COù,
- R est la constante des gaz parfaits, égale à 8,314570 J·mol-1·K-1
- T la température en kelvin
- a l'activité chimique de l'oxydant et du réducteur
- F est la constante de Faraday, égale à 96 485 C⋅mol-1 = 1 F
- n est le nombre d'électrons transférés dans la demi-réaction
- [ox] concentration de l'oxydant (ou plutôt de "tout ce qui se trouve du côté de l'oxydant")
- [red] concentration du réducteur (ou plutôt de "tout ce qui se trouve du côté du réducteur")
Histoire
L'équation de Nernst fait référence au chimiste allemand Walther Nernst qui fut le premier à la formuler, en 1889.
Remarque
On introduit parfois le terme :
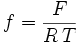 .
.L'équation de Nernst se réécrit alors sous la forme :
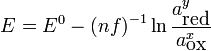
On notera aussi que ce même terme f peut s'écrire aussi sous la forme :
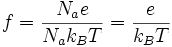
où,
Na est le nombre d'Avogadro : 6,022·1023 mol-1,
e est la charge élémentaire : 1,602·10-19 C,
kB est la constante de Boltzmann : 1,380 6·10-23 J·K-1.Autres liens
- Équation de Nernst (électrophysiologie), l'équation de Nernst appliquée au cas de la différence de concentration ionique de part et d'autre des membranes biologiques.
- Équation de Goldman-Hodgkin-Katz en voltage, généralisation de l'équation de Nernst pour le cas d'une membrane renfermant plusieurs conductances.
- Portail de la chimie
- Portail de l’électricité et de l’électronique
Catégories : Électrochimie | Thermoélectricité
Wikimedia Foundation. 2010.
