- Formation du trioxyde de souffre
-
Trioxyde de soufre
Trioxyde de soufre 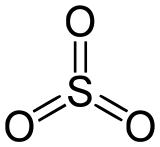
Général Nom IUPAC Trioxyde de soufre Synonymes anhydride sulfurique No CAS No EINECS Apparence liquide fumant, hygroscopique, incolore oucristaux incolores a blancs.[1] Propriétés chimiques Formule brute SO3 Masse molaire 80,063 g∙mol-1
O 59,95 %, S 40,05 %,Propriétés physiques T° fusion 16,9 °C T° ébullition 45 °C[1] Solubilité dans l'eau : réaction[1] Masse volumique (eau = 1) : 1.9[1] Thermochimie S0gaz, 1 bar 256,77 J/mol·K ΔfH0gaz -397,77 kJ/mol Cp 24,02 J/mol·K Précautions Directive 67/548/EEC 
CPhrases R : 14, 34, Phrases S : 8, 25, 36/37/39, 45, SIMDUT[2] Produit non classifié Unités du SI & CNTP, sauf indication contraire. Le trioxyde de soufre a pour formule chimique SO3.
Le trioxyde de soufre est un liquide, de densité 1,92 g/cm³, de point d'ébullition +43,7 °C, et de point de fusion +16,8 °C.
Il peut être obtenu par synthèse industrielle grâce à l'oxydation du dioxyde de soufre par l'oxygène de l'air :
- 2SO2 + O2 = 2SO3
Mélangé à de l'eau, il produit de l'acide sulfurique (H2SO4) :
- SO3 + H2O = H2SO4 (+ 88 kJ)
qui, en chauffant, bout à ~290 °C, et se redécompose en trioxyde de soufre et en eau à 340 °C.
Formation
De grandes quantités de dioxyde de soufre (SO2) sont produites en brûlant du soufre au cours de la fabrication de l’acide sulfurique. Sous l’action d’un catalyseur, ces molécules se recombinent à un autre atome d’oxygène, en sorte que la plus grande partie du dioxyde de soufre fabriqué est transformé en trioxyde de soufre. Cette transformation est très lente en l’absence de catalyseur, comme c’est le cas, dans les goutellettes d’eau, lorsque le dioxyde de soufre atmosphérique devient du trioxyde de soufre.
Le SO3 est un des deux gaz principaux qui composent l'atmosphère de Vénus (l'autre étant le CO2). Il est à l'état gazeux puisque la température moyenne sur Vénus est de 480 °C.Sources
- WebElements
- Sigma-Aldrich Co.
- NIST Standard Reference Database
- European Chemicals Bureau
- Perma Pure LLC
- The Complete Book Of Ecstacy, Chapter 3
- ChemSub Online
- ↑ a , b , c et d TRIOXYDE DE SOUFRE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « Trioxyde de soufre » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
Voir aussi
- Portail de la chimie
Catégories : Produit chimique corrosif | Oxyde | Composé du soufre
Wikimedia Foundation. 2010.
