- 107-05-1
-
Chlorure d'allyle
Chlorure d'allyle 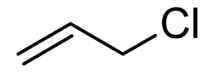
Général Nom IUPAC 3-chloroprop-1-ène No CAS No EINECS SMILES InChI Apparence liquide incolore Propriétés chimiques Formule brute C3H5Cl Masse molaire 76,525 g∙mol-1
C 47,09 %, H 6,59 %, Cl 46,33 %,Propriétés physiques T° fusion -135 °C [1] T° ébullition 45,1 °C [1] Solubilité dans l'eau : 0.337 g/100 mL (25 °C) [1] Masse volumique 0.94 g/mL T° d’auto-inflammation 390 °C Point d’éclair -32 °C Limites d’explosivité dans l’air 2.9–11.2% Précautions Directive 67/548/EEC 
Xn
F
NPhrases R : 11, 20/21/22, 36/37/38, 40, 48/20, 50, 68, Phrases S : 2, 16, 25, 26, 36/37, 46, 61, Transport - 1100 NFPA 704 Classification du CIRC Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[2] Unités du SI & CNTP, sauf indication contraire. Le chlorure d'allyle ou chlorure allylique ou encore 3-chloroprop-1-ène est le composé organique de formule semi-développée CH2=CH-CH2Cl. Il présente un groupe alcène ou allylique à côté d'un groupe chlorométhyle. Cet haloalcène liquide et incolore est quasiment insoluble dans l'eau mais est soluble dans la plupart des solvants organiques courants. Il est principalement converti en épichlorohydrine (1-chloro-2,3-époxypropane) qui est utilisée dans la production de plastiques.
Sommaire
Production
le chlorure d'allyle est préparé par réaction du chlore sur le propène. A basse température, le produit principal est le 1,2-dichloropropane mais à 500 °C, le chlorure d'allyle formé par une réaction radicalaire, devient prédominant :
- CH3CH=CH2 + Cl2 → ClCH2CH=CH2 + HCl
Environ 800 000 tonnes de chlorure d'allyl sont produits annuellement par cette réaction[3]
Réactions et utilisations
La grand majorité du chlorure d'allyle produit est converti en épichlorohydrine[3].
Au laboratoire, le chlorure d'allyle est un agent alkylant courant, pratique pour la préparation de médicaments et de pesticides. Des exemples de sa réactivité incluent sa cyanation vers le cyanure d'allyle, (CH2=CHCH2CN)[4], le couplage réductif qui donne le diallyl (CH2=CHCH2-CH2CH=CH2), l'addition oxydante sur le palladium qui donne le chlorure d'allylpalladium dimérique (C3H5)2Pd2Cl2 et la déshydrohalogénation vers le cyclopropène. Les dérives commercialement importants sont l'alcool allylique, l'allylamine et l'isocyanate d'allyl (huile de moutarde synthétique)[5] et l'allylsilane.
Sécurité
Le chlorure d'allyle est très toxique et inflammable.
Notes
- (en) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en anglais intitulé « Allyl chloride ».
- ↑ a , b et c (en) « Allyl chloride » sur ChemIDplus, consulté le 29 juin 2009
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
- ↑ a et b Ludger Krähling, Jürgen Krey, Gerald Jakobson, Johann Grolig, Leopold Miksche “Allyl Compounds” in Ullmann's Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2005. Published online: 15 June, 2000.
- ↑ Allyl Cyanide,J. V. Supniewski and P. L. Salzberg; OrgSynth, 1941, Collvol. 1, p. 46. prep=CV1P0046
- ↑ F. Romanowski, H. Klenk "Thiocyanates and Isothiocyanates, Organic" in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH: Weinheim.
- Portail de la chimie
Catégories : Produit chimique nocif | Produit chimique facilement inflammable | Produit chimique dangereux pour l'environnement | Chloroalcène | Composé allylique
Wikimedia Foundation. 2010.

