- Dioxygène liquide
-
Oxygène liquide
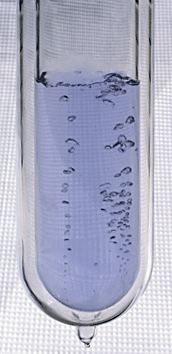 Oxygène liquide dans un vase de Dewar. Sa couleur bleue est due à l'absorption de la lumière rouge, contrairement à la couleur du ciel, qui provient de la diffusion Rayleigh.
Oxygène liquide dans un vase de Dewar. Sa couleur bleue est due à l'absorption de la lumière rouge, contrairement à la couleur du ciel, qui provient de la diffusion Rayleigh.
On désigne par oxygène liquide le dioxygène refroidi au dessous de son point de condensation, soit 90,188 K (–182,96 °C) sous la pression atmosphérique (101 325 Pa). Sa masse volumique est alors de 1 141 kg/m3, et il gèle à 50,5 K (–222,65 °C). On l'obtient par distillation fractionnée à partir de l'air.
Il est souvent désigné par l'acronyme LOX, notamment pour ses applications astronautiques.
Sommaire
 Le lanceur européen Ariane 5 ECA fonctionne à l'oxygène liquide avec de l'hydrogène liquide.
Le lanceur européen Ariane 5 ECA fonctionne à l'oxygène liquide avec de l'hydrogène liquide.
EAP P230 : PCPA
- Impulsion spécifique : 275 s
- Poussée : 6 470 kN (x 2 propulseurs)
- Durée : 129 s
1er étage : LOX / LH2
- Impulsion spécifique : 431 s
- Poussée : 1 340 kN
- Durée : 650 s
2nd étage : LOX / LH2
- Impulsion spécifique : 446 s
- Poussée : 64,7 kN
- Durée : 960 sPropriétés comburantes
C'est un liquide cryogénique qui a un coefficient d'expansion de 860:1 à 20 °C, ce qui fait qu'on l'utilise dans certains avions militaires et commerciaux comme source d'oxygène respiratoire. Il rend les matériaux très cassants à son contact en raison même de sa température très basse. C'est un agent oxydant très puissant, au contact duquel les matières organiques brûlent rapidement de façon énergétique, ou peuvent exploser de façon imprévisible lorsqu'elles sont simplement imprégnées d'oxygène liquide : c'est notamment le cas des composés pétrochimiques, y compris l'asphalte.
Cela peut poser problème lorsqu'on manipule à l'air libre de l'azote liquide car, à pression atmosphérique, ce dernier a une température inférieure au point de condensation du dioxygène de l'air, lequel peut donc se condenser à la surface du N2 liquide, formant un mélange enrichi en O2 liquide aux propriétés oxydantes inattendues pour ce qu'on pense être au départ de l'azote liquide ; au final, on peut n'avoir plus que de l'oxygène liquide une fois tout l'azote évaporé.
Utilisation comme ergol en astronautique
L'oxygène liquide était utilisé dès les années 1940 par les Allemands sous le nom de A-Stoff avec l'éthanol C2H5OH (appelé B-Stoff pour cet usage) comme combustible pour former un propergol liquide destiné aux fusées V-2. Il a été développé pendant la guerre froide pour propulser des missiles ballistiques intercontinentaux, tels que le PGM-11 Redstone américain (descendant direct du V-2 allemand, utilisant le même propergol LOX / éthanol) et le R-7 Semiorka soviétique (alias SS-6 Sapwood, dont dérive l'actuel lanceur Soyouz-FG) dès 1959, premier vrai missile ballistique intercontinental qui utilisait comme combustible un kérosène spécialement raffiné similaire au RP-1 américain.
De nos jours, l'oxygène liquide est utilisé comme comburant avec le RP-1 et l'hydrogène liquide dans un grand nombre de lanceurs tels que les fusées Delta, Atlas, Titan, Soyouz, Ariane 5 et la navette spatiale.
Tétraoxygène
L'existence de molécules de tétraoxygène O4, composées de quatre atomes d'oxygène, avait été proposée en 1924 par Gilbert Lewis pour expliquer le fait que l'oxygène liquide n'obéit pas à la loi de Curie[1] alors que les molécules de dioxygène O2 devraient donner un liquide paramagnétique, mais il semble aujourd'hui qu'en réalité les molécules O2 tendent à s'associer par paires aux spins antiparallèles pour former des structures instables de type (O2)2[2]. Des études réalisées en 2001 par spectrométrie de masse à l'Université de Rome « La Sapienza »[3] ont montré que la structure du tétraoxygène O4 correspondrait à un complexe formé d'une molécule de dioxygène à l'état fondamental avec une molécule O2 dans un état excité particulier.
Notes et références
- ↑ Gilbert N. Lewis, « The Magnetism of Oxygen and the Molecule O2 », dans Journal of the American Chemical Society, vol. 46, no 9, September 1924, p. 2027–2032 [lien DOI]
- ↑ Tatsuki Oda, « Noncollinear magnetism in liquid oxygen: A first-principles molecular dynamics study », dans Physical Review B, vol. 70, no 13, October 2004, p. 134402 [texte intégral lien DOI]
- ↑ Fulvio Cacace, « Experimental Detection of Tetraoxygen », dans Angewandte Chemie International Edition, vol. 40, no 21, October 2001, p. 4062–4065 [lien DOI]
Articles liés
Liens externes
- Encyclopédie Air Liquide : Oxygène
- Portail de l’astronautique
- Portail de la chimie
Catégories : Propulsion spatiale | Oxygène
Wikimedia Foundation. 2010.
