- Diimide
-
Diimide 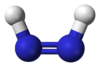
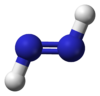
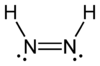
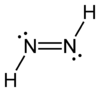
Représentations 2D et 3D des isomères cis et trans du diimideGénéral Synonymes Diazène
DiimideNo CAS
(E)
(Z)PubChem SMILES Propriétés chimiques Formule brute H2N2 [Isomères] Masse molaire[1] 30,0293 ± 0,0005 g·mol-1
H 6,71 %, N 93,29 %,Unités du SI & CNTP, sauf indication contraire. Le diimide, est un composé chimique inorganique de formule HN=NH. Les composés azo peuvent être considérés comme dérivés de ce composé par substitution des atomes d'hydrogène par des groupes organiques. Comme chaque atome d'azote porte un atome d'hydrogène, un doublet libre, et est lié à l'autre par une double liaison qui empêche la libre rotation d'axe N-N, le diimide existe en deux isomères, cis et trans.
Sommaire
Histoire
Le diimide a été isolé pour la première fois par le chimiste allemand Nils Wiberg en 1972.
Utilisations
Hydrogénation
Le cis-Diazene est un composé utile en synthèse organique; il peut être utilisé pour hydrogéner un alcène ou un alcyne (et donc les réduire en alcane), avec une stéréosélectivité du côté où les hydrogènes viennent s'additionner. Le résultat est le même type de stéréosélectivité que dans le cas d'une addition syn de dihydrogène, catalysée par un métal (hydrogénation catalytique). Les avantages d'une telle méthode de synthèse sont:
- pas de dihydrogène à pression élevée (avec des risques potentiels d'explosion);
- gaz relâchés inertes (principalement du diazote);
- pas d'utilisation de métaux coûteux (nickel de Raney, palladium, platine,…) pour catalyser la réaction.
Mécanisme réactionnel
Note et références
- Wiberg, E.; Holleman, A. F., Inorganic Chemistry, Elsevier, 2001 [lire en ligne], « 1.2.7: Diimine, N », p. 628
- Miller, Charles E. Hydrogenation with diimide. Journal of Chemical Education (1965), 42(5), 254-9. CODEN: JCEDA8 ISSN:0021-9584.[1]
- Trost et al Journal of the American Chemical Society 127 11 2005 3667 DOI:10.1021/ja042435i[2]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « diazen » (voir la liste des auteurs)
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
Wikimedia Foundation. 2010.
