- Acide nitreux
-
Acide nitreux 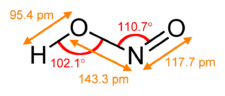
Structure de l'acide nitreux cis et trans.Général Nom IUPAC acide nitreux
nitrite d'hydrogèneNo CAS No EINECS PubChem SMILES InChI Apparence solution bleu pâle Propriétés chimiques Formule brute HNO2 [Isomères] Masse molaire[2] 47,0134 ± 0,0009 g·mol-1
H 2,14 %, N 29,79 %, O 68,06 %,pKa 3.35 à 25 °C Moment dipolaire 1,423 ± 0,005 D (cis)
1,855 ± 0,016 D (trans)[1]Propriétés électroniques 1re énergie d'ionisation ≤ 11,3 eV (gaz)[3] Unités du SI & CNTP, sauf indication contraire. L'acide nitreux est un composé chimique de formule HNO2. C'est un monoacide faible que l'on ne connaît qu'en solution. Cette solution est bleue. Ses sels (les nitrites) sont au contraire stables à pH 7.
Sommaire
Description
Son nom systématique est : acide dioxonitrique(III) ou acide nitrique III. Ses sels sont appelés nitrites.
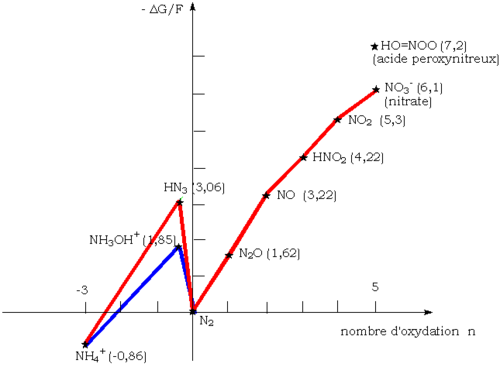
Il est particulièrement instable et se dismute à température ordinaire en monoxyde d'azote NO et en ion nitrate [NO3]-, ainsi que le montre le diagramme de Frost de l'azote donné ci-dessous :
L'azote, qui se trouve à l'état d'oxydation +3, se retrouve, après dismutation, aux états +5 et +2.
L'acide nitreux est utilisé pour préparer des dérivés azoïques (azobenzène C6H5–N=N–C6H5) à partir d'amines aromatiques, par l'intermédiaire de sels de diazonium C6H5–N+≡N·X-.
Son pKa est de 3,3.
Stockage
On le prépare en solution, car il est trop instable pour être stocké. On ajoute de l'acide chlorhydrique à du nitrite de sodium en solution :
Voir aussi
Notes et références
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 16 juin 2008, 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 2008, 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
Wikimedia Foundation. 2010.