- Acide de Lewis
-
Un acide de Lewis (du nom du chimiste américain Gilbert Newton Lewis qui en a donné la définition) est une entité chimique dont un des atomes la constituant possède une lacune électronique, ce qui la rend susceptible d'accepter un doublet d'électrons, et donc de créer une liaison covalente avec une base de Lewis. Cette lacune peut être notée en représentation de Lewis par un rectangle vide. Par exemple, un composé comme AlCl3 et BF3 possède une lacune électronique et sera donc un acide de Lewis. Aussi, les organomagnésiens R-Mg-X (très utilisés en chimie organique) sont des acides de Lewis.
Un acide de Lewis est donc un accepteur d'électrons. La définition d'un Acide de Lewis est donc bien plus générale que celle de Brönsted, car elle concerne toutes les espèces possédant une orbitale libre[1].
Exemples :
Le borane BH3 :

Le fluorure d'aluminium AlF3 :

L'ion H+ :

Le bromure de méthylmagnésium CH3MgBr :
Sommaire
Quelques exemples de réaction des acides de lewis
-
- H+ + NH3 → NH4+
- B2H6 + 2H− → 2BH4−
- BF3 + F− → BF4−
- Al2Cl6 + 2Cl− → 2AlCl4−
- AlF3 + 3F− → AlF63−
- SiF4 + 2F− → SiF62−
- PCl5 + Cl− → PCl6−
- SF4 + F− → SF5−
Un exemple typique de réaction impliquant un acide de Lewis est la réaction d’alkylation de Friedel-Crafts. L’étape principale est l’acceptation par AlCl3 d'une seul-paire d'ion de chlorure, formant AlCl4− et créant un électrophile, un ion carbonium R+.
- RCl +AlCl3 → R+ + AlCl4−
Acidité de Lewis et électrophilie
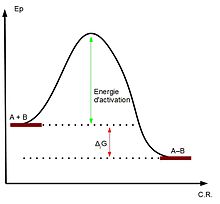
La notion d'acide de Lewis est une notion thermodynamique, c'est-à-dire qu'elle est liée à un équilibre, au contraire de la notion de électrophilie qui est cinétique et caractérise donc la vitesse de réaction avec un autre composé. Supposons ainsi un acide de Lewis A, une base B et la réaction A + B = AB. Sur un diagramme d'énergie potentielle tel que celui ci-contre, une plus forte électrophilie de A diminuera l'énergie d'activation tandis qu'une plus forte acidité augmentera en valeur absolue l'enthalpie libre molaire de réaction (ΔrG).
Voir aussi
Références
- Cours de Chimie organique, Paul Arnaud, Editions Dunod
-
Wikimedia Foundation. 2010.