- Cyanate d'ammonium
-
Cyanate d'ammonium 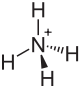
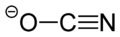
Général Nom IUPAC Cyanate d'ammonium No CAS SMILES InChI Apparence cristaux incolores Propriétés chimiques Formule brute CH4N2O [Isomères]
NH4OCNMasse molaire[1] 60,0553 ± 0,0018 g·mol-1
C 20 %, H 6,71 %, N 46,65 %, O 26,64 %,Propriétés physiques Point d’éclair 29,5 °C Unités du SI & CNTP, sauf indication contraire. Le cyanate d'ammonium a pour formule NH4CNO, il se présente sous forme de cristaux incolores.
Au début du siècle, avant la chimie organique, les chimistes isolaient des composés purs et déterminaient leurs propriétés et leur composition élémentaire. Un petit nombre de molécules organiques étaient néanmoins préparées au laboratoire par décomposition ou transformation d'autres corps.
Par exemple :
- En 1766, l'acide oxalique fut obtenu par oxydation du sucre (Torbern Olof Bergman et Carl Wilhelm Scheele)
- En 1829 Gay-Lussac réussit à former le même composé par l'action de la potasse caustique sur le bois.
- En 1828, Wöhler obtint de l'urée par pyrolyse du cyanate d'ammonium.
- Un peu plus tard, Eugène-Melchior Péligot prépara l'acétone par la distillation sèche des acétates alcalino-terreux.
Friedrich Wöhler obtint l'urée de la façon suivante : on chauffe à ébullition pendant 15 minutes, une solution aqueuse saturée de cyanate d'ammonium. Après refroidissement dans la glace, on ajoute goutte à goutte, quelques ml d'acide nitrique concentré qui précipite un solide blanc qui est filtré, lavé à l’éther et séché. On mesure ensuite le point de fusion que l'on compare à celui du produit de départ et à celui de l'urée pure.
Points de fusion : NH4CNO non mesurable > 250 °C.
Urée O=C(NH2)2 130 à 135 °CActuellement, l'obtention du cyanate d'ammonium s'effectue par neutralisation de l'ammoniac par l'acide cyanique.
Voir aussi
Notes et références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
Catégories :- Cyanate
- Composé de l'ammonium
Wikimedia Foundation. 2010.


