- Cristaux de soude
-
Carbonate de sodium
Carbonate de sodium 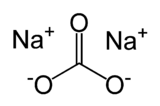
Structure du carbonate de sodium Général Nom IUPAC carbonate de sodium Synonymes carbonate de soude,
percarbonate de sodiumNo CAS No EINECS No E E500(i) Apparence poudre blanche hygroscopique. (anhydre)[1] Propriétés chimiques Formule brute Na2CO3 Masse molaire 105,9884 g∙mol-1
C 11,33 %, Na 43,38 %, O 45,29 %,Propriétés physiques T° fusion 851 °C (anhydre)[1] Solubilité dans l'eau à 20 °C : 30 g/100 ml (anhydre)[1] Masse volumique 2.5 g/cm³ (anhydre)[1] Précautions Directive 67/548/EEC 
XiPhrases R : 36, Phrases S : 2, 22, 26, [2] SIMDUT[3] 

SGH[4] 
AttentionÉcotoxicologie DL50 4090 mg/kg (rats, oral) Unités du SI & CNTP, sauf indication contraire. Le carbonate de soude ou carbonate de sodium (numéro E500(i)) est un composé ayant pour formule Na2CO3.
Dans le langage courant, on parle aussi de cristaux de soude. Le carbonate de soude a longtemps porté le nom de soude, mais il ne faut pas le confondre avec la soude caustique.
Sommaire
Obtention
Le carbonate de soude peut être obtenu à partir de gisements de natron. Dans le passé, on le trouvait dans le natron mais aussi dans les cendres d'algues (varech ou goémon en Bretagne) ou de plantes (salicorne en Méditerranée).
Le procédé Leblanc a été élaboré en 1789. Le procédé Solvay qui produit du carbonate de sodium à partir de sel et de craie l'a supplanté dès 1870 car moins coûteux et moins polluant.
Propriétés physico-chimiques
Le carbonate de soude n'est pas toxique pour l'environnement. Il peut être irritant sur la peau et il est donc préférable de le manipuler avec des gants.
Le carbonate de soude ne doit pas être confondu avec la soude caustique ni avec le bicarbonate de soude, utilisé en cuisine, notamment dans l'élaboration des pains d'épices...
Le carbonate de sodium réagit avec la plupart des acides pour donner du dioxyde de carbone. Il précipite aussi par échange d'ions, plusieurs sels métalliques solubles.
Utilisation
- Fabrication du verre
- Détergents, et en particulier les lessives
- Fabrication du bicarbonate de soude
- Fabrication d'émail pour la céramique
- composant de certains isolants à base de chanvre dans le batiment
Voir aussi
- ↑ a , b , c et d CARBONATE DE SODIUM ANHYDRE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « carbonate de sodium » sur ESIS, consulté le 20 février 2009
- ↑ « Carbonate de sodium » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Portail de la chimie
Catégories : Composé du sodium | Produit chimique irritant | Produit chimique corrosif | Carbonate | Produit chimique domestique | Régulateur alimentaire de pH | Agent de levuration
Wikimedia Foundation. 2010.