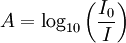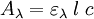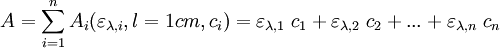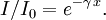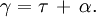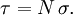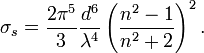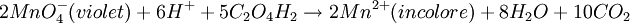- Spectrophotometrie
-
Spectrophotométrie
La spectrophotométrie est une méthode analytique quantitative qui consiste à mesurer l'absorbance ou la densité optique d'une substance chimique donnée en solution. Plus cette espèce est concentrée plus elle absorbe la lumière dans les limites de proportionnalités énoncées par la loi de Beer-Lambert.
La densité optique des solutions est déterminée par un spectrophotomètre préalablement étalonné sur la longueur d'onde d'absorption de l'espèce chimique à étudier.
Sommaire
Principe
Pour plus de détails, voir l'article Loi de Beer-Lambert
Lorsqu’une lumière d’intensité
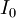 passe à travers une solution, une partie de celle ci est absorbée par le(s) soluté(s). L’intensité
passe à travers une solution, une partie de celle ci est absorbée par le(s) soluté(s). L’intensité 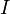 de la lumière transmise est donc inférieure à
de la lumière transmise est donc inférieure à 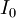 . On définit l’absorbance de la solution comme :
. On définit l’absorbance de la solution comme :On parle aussi de transmittance définie par la relation :
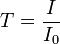 c'est-à-dire que
c'est-à-dire que 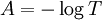
L’absorbance est une valeur positive, sans unité. Elle est d’autant plus grande que l’intensité transmise est faible.
La relation de Beer-Lambert décrit que, à une longueur d’onde λ donnée, l’absorbance d’une solution est proportionnelle à la concentration des espèces de la solution, et à la longueur du trajet optique (distance sur laquelle la lumière traverse la solution).
Alors, pour une solution limpide contenant une seule espèce absorbante :
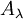 est l’absorbance ou la densité optique de la solution pour une longueur d'onde λ ;
est l’absorbance ou la densité optique de la solution pour une longueur d'onde λ ; (en mol.L-1) est la concentration de l’espèce absorbante ;
(en mol.L-1) est la concentration de l’espèce absorbante ;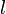 (en cm) est la longueur du trajet optique ;
(en cm) est la longueur du trajet optique ;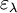 (en mol-1.L.cm-1) est le coefficient d’extinction molaire de l’espèce absorbante en solution. Il rend compte de la capacité de cette espèce à absorber la lumière, à la longueur d’onde λ.
(en mol-1.L.cm-1) est le coefficient d’extinction molaire de l’espèce absorbante en solution. Il rend compte de la capacité de cette espèce à absorber la lumière, à la longueur d’onde λ.
La loi de Beer-Lambert est additive (mais non la transmittance). Ainsi, pour une solution contenant plusieurs espèces absorbantes, l’absorbance de la solution est la somme de leurs absorbances. Pour n espèces absorbantes :
Domaine UV-visible de la spectrophotométrie
Pour plus de détails, voir l'article Spectroscopie
Un soluté coloré ou chromophore absorbe la lumière visible (longueurs d'onde comprises entre 400 et 800 nm). On parle de spectrophotocolorimétrie ou plus simplement de colorimétrie. Certaines solutions absorbent dans l'ultraviolet (longueurs d'onde inférieures à 380 nm), on parle alors de spectrophotométrie UV. Les infrarouges ne sont pas utilisés en spectrophotométrie car ils dépendent surtout de la température de la solution et non de sa concentration, ils sont plutôt couverts par la spectroscopie en infrarouge. La spectrophotométrie est plus spécifique que la spectroscopie qui couvre d'autres longueurs d'ondes du spectre électromagnétique.
Spectrophotomètre
Pour plus de détails, voir l'article Spectrophotomètre
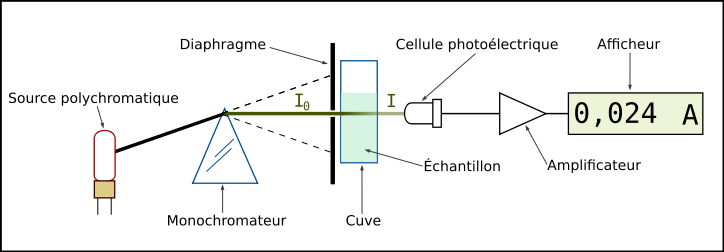
Schéma de principe du spectrophotomètre UV-visible monofaisceau Un spectrophotomètre mesure l’absorbance d’une solution à une longueur d’onde donnée. Un dispositif monochromateur permet de générer, à partir d’une source de lumière visible ou ultraviolette, une lumière monochromatique, dont la longueur d’onde est choisie par l’utilisateur. La lumière monochromatique incidente d’intensité
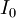 traverse alors une cuve contenant la solution étudiée, et l’appareil mesure l’intensité
traverse alors une cuve contenant la solution étudiée, et l’appareil mesure l’intensité 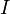 de la lumière transmise. La valeur affichée par le spectrophotomètre est l’absorbance à la longueur d’onde étudiée. Le spectrophotomètre peut être utilisé pour mesurer de manière instantanée une absorbance à une longueur d’onde donnée, ou pour produire un spectre d’absorbance (spectrophotomètre à balayage). Dans ce dernier cas, le dispositif monochromateur décrit en un temps court l’ensemble des longueurs d’onde comprises entre deux valeurs choisies par l’opérateur.
de la lumière transmise. La valeur affichée par le spectrophotomètre est l’absorbance à la longueur d’onde étudiée. Le spectrophotomètre peut être utilisé pour mesurer de manière instantanée une absorbance à une longueur d’onde donnée, ou pour produire un spectre d’absorbance (spectrophotomètre à balayage). Dans ce dernier cas, le dispositif monochromateur décrit en un temps court l’ensemble des longueurs d’onde comprises entre deux valeurs choisies par l’opérateur.Limites
Plusieurs facteurs peuvent dégrader la loi de Beer-Lambert et limiter la validité de la spectrophotométrie :
- Le domaine de mesure idéal est pour les valeurs de T situées entre 20 et 60%.
- Plusieurs aberrations optiques liés à la diffusion, la réflexion et la diffraction de la lumière peuvent fausser la mesure.
- Les phénomènes de fluorescence ainsi que d'autres particularités chimiques liées aux espèces absorbantes peuvent interférer.
- Plus la densité du soluté est importante, plus le faisceau de lumière incident sera réfracté avec une valeur donnée. Cette tendance est normalement infime mais devient plus prononcée avec les hautes concentrations. Ainsi, la réfraction réduit l'intensité de la lumière transmise et l'instrument indique faussement une absorbance plus élevée. Généralement, ce phénomène peut être évité en travaillant avec des concentrations inférieures à 0,01 mol.l-1.
Importance du phénomène de diffusion [1]
Comme la loi de Beer-Lambert le stipule, le pouvoir d'un milieu à bloquer le passage de la lumière est quantifié par un coefficient d'extinction donné par l'équation :
Cette impédance est générée par deux phénomènes distincts : l'absorbance et la diffusion.
- La diffusion intervient lorsque la lumière est défléchie par les particules du milieu de manière à ne pas atteindre l'autre côté de l'échantillon.
- L'absorbance est le processus par lequel l'énergie lumineuse est absorbée par les molécules de l'échantillon avant d'être libérée sous forme de chaleur ou emmagasinée sous forme de liaisons chimiques.
Donc que le coefficient
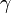 de l'équation précédente est composé par le coefficient de diffusion (
de l'équation précédente est composé par le coefficient de diffusion (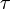 ) ainsi que celui de l'absorption (
) ainsi que celui de l'absorption (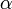 ), c'est à dire :
), c'est à dire :Le coefficient de diffusion peut être exprimé par le produit de la concentration des particules,
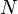 , et la section efficace de celles-ci,
, et la section efficace de celles-ci, 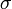 (à supposer que ces particules sont homogènes et régulièrement réparties dans le milieu), on a :
(à supposer que ces particules sont homogènes et régulièrement réparties dans le milieu), on a :La section efficace, qui est une mesure de la proportion de lumière diffusé par particule, est fonction de leur taille. En effet, pour les particules de petite taille (p. ex. leur diamètre représente 10% de la longueur d'onde incidente) la diffusion de Rayleigh prédomine. La diffusion de Rayleigh dépend de la longueur du parcours, de la concentration des particules diffusantes, de la longueur d'onde et de la polarisation de cette dernière. Pour une particule idéalement sphérique, la section efficace de Rayleigh s'écrit :
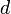 est le diamètre des particules,
est le diamètre des particules,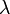 est la longueur d'onde,
est la longueur d'onde,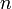 est l'indice de réfraction.
est l'indice de réfraction.
Cette équation prédit que les courtes longueur d'ondes seront les plus diffusées.
Pour des particules plus grosses que la longueur d'onde, elles font l'objet d'un phénomène plus complexe appelé diffusion de Mie. Puisque la lumière sera diffusée selon différents angles, dans ce cas la forme des particules doit être prise en compte dans la section efficace. La section efficace maximale est obtenu quand la taille de la particule est proche de la longueur d'onde incidente. La diffusion diminue de plus en plus que la différence entre la taille de la particule et la longueur d'onde augmente (c'est le cas de la spectrophotométrie moléculaire).Applications
- Détermination d'une concentration inconnue
Connaissant le spectre d'absorption d'une espèce chimique, on peut mesurer, à l'une de ses longueurs d'onde
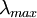 (là où l'absorption est maximale) les variations de l'intensité
(là où l'absorption est maximale) les variations de l'intensité 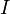 d'un faisceau lumineux traversant une même épaisseur
d'un faisceau lumineux traversant une même épaisseur 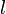 de solutions de concentrations diverses.
de solutions de concentrations diverses.Ceci permet d'établir expérimentalement la courbe
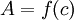 reliant l'absorbance et la concentration de la substance étudiée (avec
reliant l'absorbance et la concentration de la substance étudiée (avec 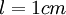 ), en effectuant les mesures de
), en effectuant les mesures de  pour diverses concentrations. Cette courbe est une courbe d'étalonnage.
pour diverses concentrations. Cette courbe est une courbe d'étalonnage.La courbe expérimentale d'étalonnage permet ensuite de déterminer la concentration inconnue d'une solution de cette substance par simple mesure de son absorbance et report sur le graphe
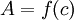 .
.La loi de Lambert-Beer a des limites. Elle n'est linéaire que dans un intervalle de concentrations réduit regroupant des valeurs inférieures à 10-2mol.l-1.
- Suivi de la cinétique d'une réaction chimique
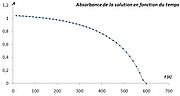
Lorsqu'au cours d'une réaction chimique dont on veut étudier la cinétique de l'une des espèces chimique en solution, on peut par spectrophotométrie d'absorption suivre la concentration de cette espèce (généralement colorée). Si cette espèce est un réactif, l'absorbance de la solution diminue au cours du temps. Si au contraire, c'est un produit de la réaction, l'absorbance de la solution augmente au cours du temps.
Exemples
- On peut suivre la cinétique de la réaction d'oxydo-réduction en milieu acide, entre l'acide oxalique C2H2O4 par l'ion permanganate MnO4- (couleur violette) par la mesure de la diminution d'absorbance de ce dernier pour la longueur d'onde λ = 540 nm.
Voir aussi
Références
James HENKEL, Essentials of drug product quality (p 130,133). 1978, The Mosby Company, (ISBN 0801600316).
Liens externes
- Portail de la chimie
- Portail de la biochimie
Catégories : Spectroscopie | Chimie analytique | Instrument de mesure
Wikimedia Foundation. 2010.