- Chloroplatinate
-
Acide hexachloroplatinique hexahydraté
Acide hexachloroplatinique hexahydraté 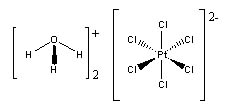
Général Nom IUPAC Hexachloroplatinate (IV)
de dihydrogène hexahydratéNo CAS No EINECS Apparence solide brun rouge Propriétés chimiques Formule brute H14Cl6O6Pt [Isomères]
H2PtCl6,(H2O)6Masse molaire 517,91 g∙mol-1
H 2,72 %, Cl 41,07 %, O 18,54 %, Pt 37,67 %,Propriétés physiques T° fusion 60 °C (333 K) T° ébullition décomposition Solubilité très soluble dans l'eau Masse volumique 2,431 , solide Précautions Directive 67/548/EEC 
TPhrases R : 25, 34, 42/43, Phrases S : (1/2), 22, 26, 36/37/39, 45, SIMDUT[1] 

SGH[2] 


DangerUnités du SI & CNTP, sauf indication contraire. Dihydrogène hexachloroplatinate (IV) hexahydrate, ou sous sa forme commerciale, lacide hexachloroplatinique hexahydraté ou ACP de formule brute H2PtCl6, 6H2O est un solide rouge-orangé, très hygroscopique, ce qui rend sa manipulation assez délicate.
Il est utilisé comme catalyseur dans les réactions Hydrosilylations. N'étant pas soluble dans les solvants usuels (hydrocarbures aliphatiques ou aromatiques) et étant très peu efficace en phase hétérogène, il est généralement utilisé en solution dans un alcool : l'isopropanol ou le tertiobutanol, plus rarement dans du Tétrahydrofurane.
Lorsqu'il est dissous dans l'alcool isopropylique, il prend le nom de catalyseur de Speier. Il s'avère efficace, selon les espèces chimiques mises en jeu, à très faible concentration (jusqu'à 5.10-8 mole par mole d'oléfine, dans certains cas).
Il est obtenu à partir d'eau régale sur le platine.
Voir aussi
Références
- ↑ « Acide hexachloroplatinique (IV) » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Portail de la chimie
Catégories : Composé du platine | Produit chimique toxique | Produit chimique corrosif | Composé du chlore | Catalyseur | Acide
Wikimedia Foundation. 2010.
