- 75-36-5
-
Chlorure d'éthanoyle
Chlorure d'éthanoyle 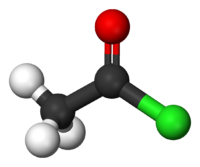
Modèle de la molécule Général Synonymes chlorure d'acétyle
Chlorure acétique
Chlorure de l'acide acétiqueNo CAS No EINECS Apparence liquide fumant incolore, d'odeur âcre.[1] Propriétés chimiques Formule brute C2H3ClO [Isomères]
CH3COClMasse molaire 78,498 g∙mol-1
C 30,6 %, H 3,85 %, Cl 45,16 %, O 20,38 %,Propriétés physiques T° fusion -112 °C[1] T° ébullition 51 °C[1] Solubilité dans l'eau : réaction[1] Masse volumique (eau = 1) : 1.11[1] T° d’auto-inflammation 390 °C[1] Point d’éclair 5 °C c.f.[1] Limites d’explosivité dans l’air en volume % dans l'air : 7.3-19[1] Pression de vapeur saturante à 20 °C : 32 kPa[1] Précautions Directive 67/548/EEC 
C
FPhrases R : 11, 14, 34, Phrases S : (1/2), 9, 16, 26, 45, Transport - 1717 NFPA 704 SIMDUT[2] 


SGH[3] 

DangerUnités du SI & CNTP, sauf indication contraire. Le chlorure d'éthanoyle appelé également chlorure d'acétyle est un chlorure d'acide dérivé de l'acide acétique (acide éthanoïque). De formule CH3COCl, il appartient à la classe des composés organiques appelés halogénures d'acyle (aussi halogénures d'acide). Il est irritant et facilement inflammable.
À température ambiante, c'est un liquide transparent et incolore. Le chlorure d'éthanoyle n'existe pas dans la nature, parce qu'il réagit avec l'eau pour former de l'acide acétique et du chlorure d'hydrogène. Manipulé à l'air libre, cette réaction avec la vapeur d'eau ambiante provoque une fumée blanche toxique de chlorure d'hydrogène gazeux et de goutelettes d'eau.
Il est synthétisé à partir d'acide acétique que l'on fait réagir avec du chlorure de thionyle :
On l'utilise comme réactif pour l'acétylation dans la synthèse ou la transformation de composés chimiques, par exemple pour l'estérification (exemple ci-dessous) et la réaction de Friedel-Crafts.
- CH3COCl + HO-CH2-CH3 → CH3-COO-CH2-CH3 + H-Cl
De telles acylations sont souvent effectuées en présence d'une base comme la pyridine, la triéthylamine ou le DMAP, qui en tant que catalyseur favorise la réaction et en tant que base neutralise l'acide chlorhydrique résultant.
Source
- (en) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en anglais intitulé « Acetyl chloride ».
Lien externe
Références
- ↑ a , b , c , d , e , f , g , h et i CHLORURE D'ACETYLE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « Chlorure d'acétyle » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Portail de la chimie
Catégories : Produit chimique corrosif | Produit chimique facilement inflammable | Produit chimique qui réagit avec l'eau | Chlorure d'acyle
Wikimedia Foundation. 2010.