- 67-68-5
-
Diméthylsulfoxyde
Diméthylsulfoxyde 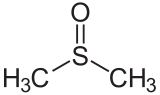
Structure 3D du diméthylsulfoxyde Général Nom IUPAC diméthylsulfoxyde Synonymes sulfinylbisméthane
Méthylsulfoxyde
DMSONo CAS No EINECS Code ATC
DrugBank PubChem FEMA SMILES InChI Apparence liquide hygroscopique, incolore.[1] Propriétés chimiques Formule brute C2H6OS [Isomères] Masse molaire 78,133 g∙mol-1
C 30,74 %, H 7,74 %, O 20,48 %, S 41,04 %,Propriétés physiques T° fusion 18,5 °C [2] T° ébullition 190,9 °C [2] Solubilité 1 000 g∙l-1 à 20 °C [3] Masse volumique (eau = 1) : 1.1[1] T° d’auto-inflammation 270 °C [3] Point d’éclair 88 °C [3] Limites d’explosivité dans l’air 1,8- Vol.% [3] Pression de vapeur saturante à 20 °C : 59.4 Pa[1] Viscosité dynamique 1,996 cP à 20 °C (293 K) Thermochimie S0liquide, 1 bar 188,78 J∙mol-1 [2] ΔfH0gaz -150,5 kJ∙mol-1 à 25 °C [2] ΔfH0liquide -203,4 kJ∙mol-1 à 25 °C [2] ΔfusH° 14,368 kJ∙mol-1 à 18,5 °C [2] ΔvapH° 52,9 kJ∙mol-1 à 25 °C [2] Cp 149,39 J∙mol-1∙K-1 à 25 °C [2] PCI -2 037,3 kJ∙mol-1 [2] Précautions NFPA 704 SIMDUT[4] 
Unités du SI & CNTP, sauf indication contraire. Le diméthylsulfoxyde noté aussi DMSO est un solvant organique de formule brute C2H6OS.
Sommaire
Utilisation
C'est un liquide incolore qui est utilisé en chimie et en pharmaceutique pour sa capacité à solubiliser de nombreux solvants organiques, mais également des sels du fait de sa forte polarité[5]. Dilué de 5 à 20%, il est utilisé comme agent cryoprotecteur lors de la congélation de cellules, ou de gamètes. Il présente également des propriétés anesthésiques et anti-bactériennes[5].
Propriétés physico-chimiques
Le diméthylsulfoxyde est aussi un produit entraînant une plus grande absorption des toxines par les pores de la peau lorsqu'il est mis en contact avec celle-ci. C'est un solvant aprotique polaire (de plus on observe un effet mésomère sur la double liaison O).
Production et synthèse
La production industrielle de DMSO consiste en l'oxydation catalytique du sulfure de diméthyle en présence d'oxygène ou de dioxyde d'azote[5]. Sans catalyseur la réaction est possible à une pression de 7,2 MPa et à 105 °C avec un rendement supérieur à 90%[6].
Notes et références
- ↑ a , b et c DIMETHYLSULFOXYDE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ a , b , c , d , e , f , g , h et i Dimethyl sulfoxide sur http://www.nist.gov/. Consulté le 17 mars 2009
- ↑ a , b , c et d Entrée de « Dimethyl sulfoxide » dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 17 mars 2009 (JavaScript nécessaire)
- ↑ « Sulfoxyde de diméthyle » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ a , b et c Kathrin-Maria Roy, Ullmann's Encyclopedia of Industrial Chemistry, Sulfones and Sulfoxides, Wiley-VCH Verlag GmbH & Co, 2000
- ↑ (en) Paul E. Correa et Dennis P. Riley, « Highly selective direct oxidation of thioethers to sulfoxides using molecular oxygen », dans Journal of Organic Chemistry, vol. 50, no 10, mai 1985, p. 1787-1788
- Portail de la chimie
Catégories : Composé organo-sulfuré | Solvant
Wikimedia Foundation. 2010.

