- 5768-87-6
-
Phénolphtaléine
Phénolphtaléine[1] 
Modèle 3D de la phénolphtaléine (forme acide) Général Nom IUPAC 3,3-bis(4-hydroxyphényl)-1-(3H)-monobenzofuranone
(forme acide)No CAS (acide)
(basique)
(Na)No EINECS
(Na)Apparence cristaux blancs

Propriétés chimiques Formule brute C20H14O4 [Isomères]
C20H12O42-,Na+ (Na)Masse molaire 318,3228 g∙mol-1
C 75,46 %, H 4,43 %, O 20,1 %,
362,28 g.mol-1 (Na)pKa pKa1 : <0
pKa2 : 9,4[2]Propriétés physiques T° fusion 258 à 263 °C Solubilité eau[3] : 1,4 g.mol-1
éthanol[3] : 80 g.mol-1Masse volumique 1,299 Précautions Directive 67/548/EEC 
XnPhrases R : acide : 22 - 40 Phrases S : acide : 36/37 - 45 basique : 24/25Classification du CIRC Groupe 2B : Peut-être cancérogène pour l'homme[4] Unités du SI & CNTP, sauf indication contraire. La phénolphtaléine ou 3,3-bis(4-hydroxyphényl)-1-(3H)-monobenzofuranone est composé organique de formule chimique C20H14O4. C'est un un indicateur de pH, c'est à dire un composé qui change de couleur selon la valeur du pH de la solution dans laquelle on le place.
Sommaire
Histoire
La phénolphtaléine fut découverte et synthétisée en 1871 par Adolf von Baeyer, par condensation de l'anhydride phtalique sur deux équivalents de phénol. Elle tire son nom des deux réactifs.
Structure chimique de la phénolphtaléine
Le changement de couleur de la phénolphtaléine est due à la modification de la structure chimique de la molécule lors du passage de la forme protonée (milieu acide) à celle de sa forme déprotonée (milieu basique). Dans le cas de la phénolphtaléine, la forme acide présente une structure aromatique (présence de 3 cycles benzéniques) alors que la forme basique est de type quinoïdique.
La forme basique de la phénolphtaléine est généralement associée à deux ions Na+. Il s'agit donc d'un sel de disodium.
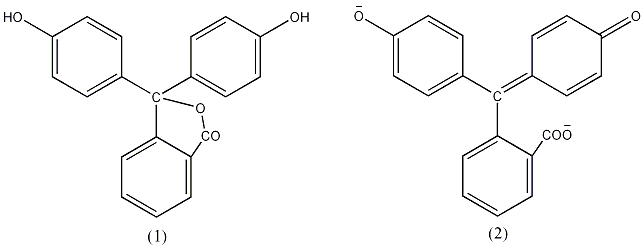 Structure chimique de la phénolphtaléine sous forme acide (1) et sous forme basique (2).
Structure chimique de la phénolphtaléine sous forme acide (1) et sous forme basique (2).
Réaction en présence de base
En solution, la phénolphtaléine peut se présenter sous plusieurs formes en fonction de la quantité relative de base présente dans le milieu.
- I. Pour des solutions acides : la phénolphtaléine est sous sa forme dite acide. La molécule possède un cycle de type lactone (1).
- II. Lors d'un ajout de base, le cycle lactone s'ouvre et évolue vers une structure triphénylcarbinol (2).
- III. Si on continue à ajouter de la base, on amène la perte d'une molécule d'eau dans la structure et on forme une espèce ionique résonante de couleur rouge pourpre (3).
- IV. Pour un excès de base, la coloration pourpre disparait et le milieu redevient incolore traduisant la formation en solution du composé (4).
Indicateur de pH
La phénolphtaléine fait partie de la famille des phtaléines, c'est-à-dire les indicateurs colorés qui dérivent du triphénylméthane et qui possèdent un cycle lactone R-COO-R.
Couleurs de la phénolphtaléine forme acide
incolorezone de virage[2]
pH 8,2 à pH 10,0forme basique
rose- Sous forme acide, la phénolphtaléine est incolore alors que sa forme basique est de couleur rose vif. Son pKIn est de 9.4 ce qui signifie que le virage (c'est-à-dire le changement de coloration) de cet indicateur se fait en milieu basique. Sa zone de virage est située entre un de pH = 8,2 (passage de l'incolore au rose) et 10,0. Autrement dit , la phénolphtaléine est un marqueur pour les solutions basiques , c’est-à-dire ayant un pH > 7.
- Deux autres zones de virage peu connues et très peu utilisées peuvent caractériser la phénolphtaléine. L'une se situe à pH ≈ 0, la molécule prend une teinte orange pour des pH négatifs. L'autre se situe en milieu très basique, la phénolphtaléine passe alors du rose à l'incolore couleur rose super clair.
Annexes
Références
- ↑ Acros Organics, Reference Handbook of Fine Chemicals, p.1459-1460
- ↑ a et b (en) David R. Lide, Handbook of Chemistry and Physics 84th edition (2003/2004), CRC Press, 2004, p.8-20
- ↑ a et b (de) de:Phenolphthalein sur la WP germanophone
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 2B : Peut-être cancérogènes pour l'homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
Liens externes
- Fiche de sécurité sur le site de l'académie de Nancy-Metz
- Portail de la chimie
Catégories : Produit chimique nocif | Indicateur de pH | Lactone | Phénol
Wikimedia Foundation. 2010.