- Trioxyde de carbone
-
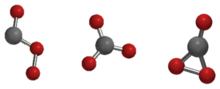 Les isomères Cs, D3h et C2v du trioxyde de carbone.
Les isomères Cs, D3h et C2v du trioxyde de carbone.
Le trioxyde de carbone (CO3) est un oxyde instable de carbone. Il y a trois isomères possibles pour le trioxyde de carbone de symétrie Cs, D3h ou C2v. Le CO3 C2v a été montré par plusieurs études comme étant l'état fondamental de la molécule[1],[2].
Le trioxyde de carbone ne doit pas être confondu avec l'ion stable carbonate (CO32−).
Le trioxyde de carbone peut être produit dans la zone de dérive d'une décharge corona négative par réaction entre le dioxyde de carbone (CO2) et l'oxygène atomique (O) créé à partir de l'oxygène moléculaire (O2) par des électrons libres du plasma[3].
Une autre méthode reportée est la photolyse d'ozone (O3) dissous du CO2 liquide ou dans un mélange CO2/SF6 à -45 °C, irradié à 253,7 nm. La formation de CO3 est inférée mais il apparaît qu'il se désintègre spontanément via 2CO3 → 2CO2 + O2 avec une durée de vie plus courte qu'une minute[4].
Le trioxyde de carbone peut être formé par soufflage d'ozone sur de la glace carbonique (CO2 solide) et il a également été détecté dans des réactions entre le monoxyde de carbone (CO) et le dioxygène (O2).
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Carbon trioxide » (voir la liste des auteurs)
- Tim Kowalczyk, Electronic structure and spectroscopy of carbon trioxide
- T. Kowalczyk and A. I. Krylov, « Electronic structure of carbon trioxide and vibronic interactions involving Jahn-Teller states », dans J. Phys. Chem. A, vol. 111, no 33, 2007, p. 8271 – 8276 (ISSN 1089-5639) [lien PMID, lien DOI]
- Sabin, J. R, « A theoretical study of the structure and properties of carbon trioxide », dans Chemical Physics Letters, vol. 11, no 5, 1971, p. 593–597 [texte intégral, lien DOI]
- DeMore W. B., Jacobsen C. W., « Formation of carbon trioxide in the photolysis of ozone in liquid carbon dioxide », dans Journal of Physical Chemistry, vol. 73, no 9, 1969, p. 2935–2938 [lien DOI]
- Sobek V., Skalný J. D., « A simple model of processes in the drift region of negative corona discharge in a mixture of air with halocarbons », dans Czechoslovak Journal of Physics, vol. 43, no 8, 1993, p. 807 [texte intégral, lien DOI]
- Pople J. A. , Seeger U., Seeger R., Schleyer P. v. R., « The structure of carbonate », dans Journal of Computational Chemistry, vol. 1, no 2, 2004, p. 199–203 [lien DOI]
- Moll N. G., Clutter D. R., Thompson W. E., « Carbonate: Its Production, Infrared Spectrum, and Structure Studied in a Matrix of Solid CO2 », dans The Journal of Chemical Physics, vol. 45, no 12, 1966, p. 4469–4481 [lien DOI]
- Gimarc B. M., Chou T. S., « Geometry and Electronic Structure of Carbon Trioxide », dans The Journal of Chemical Physics, vol. 49, no 9, 1968, p. 4043–4047 [lien DOI]
- DeMore W. B., Dede C., « Pressure dependence of carbon trioxide formation in the gas-phase reaction of O(1D) with carbon dioxide », dans Journal of Physical Chemistry, vol. 74, no 13, 1970, p. 2621–2625 [lien DOI]
- Francisco J. S., Williams I. H., « A theoretical study of the force field for carbon trioxide », dans Chemical Physics, vol. 95, no 3, 1985, p. 373 [lien DOI]
Catégories :- Oxyde de carbone
- Composé inorganique du carbone
Wikimedia Foundation. 2010.
