- 281-23-2
-
Adamantane
Adamantane 
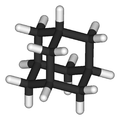
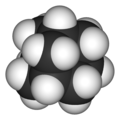
Général Nom IUPAC tricyclo[3.3.1.13,7]décane Synonymes adamantane No CAS No EINECS PubChem ChEBI SMILES InChI Apparence solide cristallin incolore de structure cubique face centrée Propriétés chimiques Formule brute C10H16 [Isomères] Masse molaire 136,234 g∙mol-1
C 88,16 %, H 11,84 %,Moment dipolaire 0 D Propriétés physiques T° fusion 269 °C[1] Masse volumique 1,07 g∙cm-3 à 20 °C, solide Précautions Directive 67/548/EEC 
Xi
FPhrases R : - [2] Unités du SI & CNTP, sauf indication contraire. L'adamantane ou tricyclo[3.3.1.13,7]décane est un composé cristallin, incolore avec une odeur rappelant celle du camphre[3]. De formule brute C10H16, c'est un polycyclo-alcane et aussi le plus simple des diamondoïdes, terme rare qui qualifie les composés qui par certains côtés, ici la structure, rappellent le carbone diamant. L'adamantane a été découvert dans le pétrole en 1933[4]. Son nom dérive du grec Ἀδάμας (adamas : « indomptable », d'adamastos : « inflexible, inébranlable ») à cause de sa structure qui calque la structure cubique du diamant et du suffixe ane des alcanes[5]. L'adamantane est le plus stable des isomères C10H16.
Sommaire
Synthèse
L'adamantane a été synthétisé pour la première fois par Vladimir Prelog en 1941[6][7]. Une méthode plus pratique a été trouvée par Paul von Rague Schleyer en 1957. Elle consiste en l'hydrogénation du dicyclopentadiène suivi par un réarrangement intramoléculaire catalysé par un acide[8][9].
Emploi
L'andamantane lui-même jouit de peu d'applications du fait qu'il est un hydrocarbure sans fonction chimique. Il est utilisé pour certain masques de photolithogravure en microélectronique[10]. Il est aussi utilisé dans la formulation de certains polymères.
Pour la spectroscopie RMN à l'état solide, l'adamanatane est un étalon, référence pour les déplacements chimiques[11].
Dans les lasers à colorants, l'adamantane peut être utilisé pour étendre la vie du milieu amplificateur car il ne peut être photo-ionisé, ses bandes d'absorption se trouvent dans l'ultraviolet. Les énergies de photo-ionisation de l'adamantane et de plusieurs autres diamondoïdes plus gros ont récemment (en 2007) été déterminées[12].
Dérivés
Les dérivés de l'adamantane sont utilisés en médecine, par exemple l'amantadine, l'adapalène, la mémantine ou la rimantadine. Des adamantanes condensés et d'autres diamondoïdes ont été isolés en petites quantités par distillation fractionnée du pétrole. Ces composés sont intéressants comme approximation moléculaire de la structure cubique du diamant, bordée par des liaisons C-H. Le 1,3-déshydroadamantane est un membre de la famille des propellanes.
Au total, chaque année, environ 10.000 tonnes d'adamantane et de ses dérivés sont produits[13].
Analogues
Beaucoup de molécules adoptent une structure en cage de type diamondoïde. Les composés particulièrement utiles avec ce type de structure sont P4O6, As4O6, P4O10 (= (PO)4O6), P4S10 (= (PS)4S6) et N4(CH2)6[14].
Notes
- (en) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en anglais intitulé « Adamantane ».
- ↑ http://msds.chem.ox.ac.uk/AD/adamantane.html
- ↑ http://www.alfa.com/content/msds/french/A14041.pdf
- ↑ http://www.chemicalland21.com/arokorhi/lifescience/phar/ADAMANTANE.htm
- ↑ Landa, S.; Machácek, V.; Collection Czech. Chem. Commun., 1933, 5, p. 1.
- ↑ Alexander Senning. Elsevier's Dictionary of Chemoetymology, Elsevier, 2006. (ISBN 0444522395)
- ↑ Über die Synthese des Adamantans, Prelog, V.; Seiwerth,R.; Berichte , 1941, 74, pp. 1644–1648. DOI:10.1002/cber.19410741004
- ↑ Über eine neue, ergiebigere Darstellung des Adamantans, Prelog, V.; Seiwerth,R.; Berichte, 1941, 74, pp. 1769–1772. DOI:10.1002/cber.19410741109
- ↑ A Simple Preparation of Adamantane, Schleyer, P. von R.; J. Am. Chem. Soc., 1957, 79, pp. 3292–3292. DOI:10.1021/ja01569a086
- ↑ Adamantane, Schleyer, P. von R.; Donaldson, M. M.; Nicholas, R. D.; Cupas, C.; OrgSynth, 1973, 5, p. 16.
- ↑ Resist Composition and Pattern Forming Process, Watanabe, Keiji et al.; United States Patent Application 20010006752, 2001.
- ↑ Chemical Shift referencing in MAS solid state NMR, Morcombe, Corey R.; Zilm, Kurt W.; J. Magn. Reson., 2003, 162, pp. 479–486. DOI:10.1016/S1090-7807(03)00082-X
- ↑ Experimental determination of the ionization potentials of the first five members of the nanodiamond series, Lenzke, K. ; Landt, L.; Hoener, M. et al.; J. Chem. Phys., 2007, 127, p.084320. DOI:10.1063/1.2773725
- ↑ de:Adamantane sur de:wp
- ↑ The Chemistry of Inorganic and Organometallic Compounds with Adamantane-Like Structures, Vitall, J. J. ; Polyhedron, 1996, 15, pp. 1585–1642. DOI:10.1016/0277-5387(95)00340-1
- Portail de la chimie
Catégories : Produit chimique irritant | Produit chimique facilement inflammable | Dérivé d'adamantane
Wikimedia Foundation. 2010.
