- Hapticité
-
Le terme hapticité est utilisé pour décrire comment un groupe contiguë d'atomes d'un ligand sont coordinés à un atome central. L'hapticité d'un ligand est désigné par la lettre grecque η. En général cette notation est complétée par le nombre d'atomes de ligand liés à l'atome central, placé en exposant. Cette notation n'est en revanche pas utilisée quand il n'y a qu'un seul atome coordiné (la notation κ est alors préférée).
Sommaire
Historique
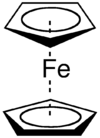
La nécessité de compléter la nomenclature pour les composés organométalliques apparait dans les années 1950 lorsque Dunitz, Orgel et Rich décrivent la structure du complexe sandwich ferrocène par étude cristallographique aux rayons X[1]. Dans cette structure un atome de Fer est pris en sandwich entre deux cyclopentadiènes parallèles. Cotton propose plus tard le terme hapticité qui dérive du préfixe hapto (du Grec haptein, lier, pour indiquer le contact ou l'acollement) placé devant le nom du composé[2]. La lettre grecque η est alors utilisée pour indiquer le nombre d'atomes qui se suivent d'un ligand liés à un atome central. Le terme est employé habituellement pour décrire des ligands contenant des systèmes π étendus ou avec une liaison agostique non évidente d'après la formule.
Composés historiquement importants où les ligands sont décris avec l'hapticité
- Ferrocène - bis(η5-cyclopentadiène)fer
- Uranocène - bis(η8-1,3,5,7-cyclooctatétraène)uranium
- W(CO)3(PPri3)2(η2-H2 ) - le premier composé synthétisé avec ligand H2[3],[4].
- IrCl(CO)[P(C6H5)3]2(η2-O2) -le dérivé oxygéné qui se forme de manière réversible lorsqu'on fait réagir le complexe de Vaska avec de l'oxygène.
Changement d'hapticité
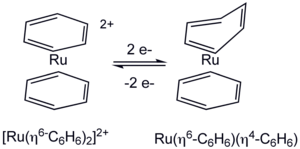
L'hapticité d'un ligand peut changer au cours d'une réaction chimique, par exemple lors d'une oxydo-réduction[5]:
Il y a passage de cycles benzéniques η6 à un cycle η4 et l'autre η6.
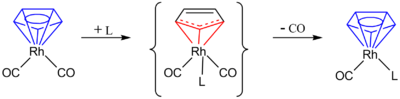
De manière similaire l'hapticité peut changer lors d'une réaction de substitution:
Ici le cyclopentadiènyl η5cyclopentadienyl change en cyclopentadiènyl η3, ce qui permet d'avoir un ligand L supplémentaire qui apporte deux électrons. L'hapticité η5 est restaurée en ôtant une molécule CO supplémentaire et en apportant deux électrons encore grâce au ligand cyclopentadiènyl. L'effet indényle décrit également des changements d'hapticité lors d'un réaction de substitution.
Hapticité et fluxionalité
Les molécules possédants des ligands d'hapticité multiples ont souvent la capacité de subir des réarrangements intramoléculaires rapides, des atomes étant interchangés entre structures équivalentes (fluxionalité). Pour les complexes organométalliques de ce type, deux classes de fluxionalité prédominent:
- cas 1: quand l'hapticité est inférieure au nombre de carbones d'hybridation sp2. Dans cette situation, le métal migre souvent de carbone à carbone, en maintenant une hapticité nette constante. Le ligand η1-C5H5 dans (η5-C5H5)Fe( η1-C5H5)(CO)2 se réarrange rapidement en solution de telle manière que le fer lie alternativement chaque carbone du ligand 1-C5H5. Cette réaction est dite dégénérée. C'est un exemple de réarrangement sigmatropique.
- cas 2: des complexes contenant des ligands cycliques d'hapticité strictement supérieure à 1 et même maximisée. Ces ligands ont tendance à tourner. Un exemple bien connu est le ferrocène Fe(η5-C5H5)2 dans lequel le groupe cyclopentadiényl tourne avec une faible barrière énergétique autour de l'axe principal de la molécule.
Voir aussi
- Denticité
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « hapticity » (voir la liste des auteurs)
- J. Dunitz, L. Orgel, A. Rich (1956). "The crystal structure of ferrocene". Acta Crystallographica 9: 373–5. DOI:10.1107/S0365110X56001091
- F. A. Cotton (1968). "Proposed nomenclature for olefin-metal and other organometallic complexes". J. Am. Chem. Soc. 90 (22): 6230–6232. DOI:10.1021/ja01024a059
- Kubas, Gregory J. (March 1988). "Molecular hydrogen complexes: coordination of a σ bond to transition metals". Accounts of Chemical Research 21 (3): 120–128. DOI:10.1021/ar00147a005
- Kubas, Gregory J. (2001). Metal Dihydrogen and σ-Bond Complexes - Structure, Theory, and Reactivity (1 ed.). New York: Kluwer Academic/Plenum Publishers. LCCN 00-059283. (ISBN 978-0306464652)
- Huttner, Gottfried; Lange, Siegfried; Fischer, Ernst O. (1971). "Molecular Structure of Bis(Hexamethylbenzene)-Ruthenium(0)". Angewandte Chemie, International Edition in English 10 (8): 556–557. DOI:10.1002/anie.197105561
Wikimedia Foundation. 2010.