- Disulfure de dihydrogène
-
Disulfure de dihydrogène 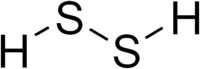
Général Nom IUPAC disulfure de dihydrogène Synonymes disulfure d'hydrogène, persulfure d'hydrogène No CAS PubChem SMILES InChI Apparence liquide jaune huileux Propriétés chimiques Formule brute H2S2 [Isomères] Masse molaire[1] 66,146 ± 0,01 g·mol-1
H 3,05 %, S 96,96 %,Propriétés physiques T° fusion -89,8 à -88,6 °C[2] T° ébullition 70,7 °C [2] Masse volumique 1,3279 g·cm-3 à 25 °C [3] Thermochimie ΔvapH° 33,78 kJ·mol-1 (1 atm, 25 °C)[4] Composés apparentés Autres composés sulfure d'hydrogène, peroxyde d'hydrogène Unités du SI & CNTP, sauf indication contraire.
Le disulfure de dihydrogène (H2S2) ou disulfure d'hydrogène est un composé inorganique, qui se présente sous la forme d'un liquide jaune, avec une odeur nauséabonde proche de celle du sulfure d'hydrogène (H2S).Sommaire
Propriétés physico-chimiques
La structure du disulfure de dihydrogène est similaire à celle du peroxyde d'hydrogène, avec deux atomes centraux de soufre et deux atomes externes d'hydrogène. Cependant l'angle diédral de la molécule est différent, puisque l'assemblage H-S-S forme un angle quasiment droit dans le cas du conformère syn. Cet angle est exactement de 90,6° pour la liaison H-S-S, alors qu'il est est de 113,7° pour H-O-O.
La liaison S-S à une longueur de 2,055 Å (1,490 pour la liaison O-O) et la liaison S-H une longueur de 1,352 Å (0,970 pour O-H)[5],[6].
Production et synthèse
Le disulfure d'hydrogène peut être synthétisé par dissolution dans l'eau de polysulfures d'alcalins ou d'alcalino-terreux. Lorsqu'on ajoute à la solution de l'acide chlorhydrique concentré à -15 °C, une huile jaune composée d'un mélange de polysulfanes (H2Sn) se forme sous la phase aqueuse. On sépare le disulfure des autres polysulfures (essentiellement des trisulfures) par distillation fractionnée[7],[8].
Le disulfure d'hydrogène se décompose aisément en sulfure d'hydrogène (H2S) et en soufre[8]. Dans la chimie des composés organo-sulfurés, le disulfure de dihydrogène est additionné aux alcènes pour obtenir des disulfures et des thiols[9].
Effets sur la santé
Le disulfure d'hydrogène a été décrit comme « ayant une odeur forte et irritante » qui ressemble à celle du camphre ou du chlorure de soufre, provoquant « des larmes et une sensation de brulures dans les narines »[8]. Fortement concentré, il peut être la cause de vertiges, de désorientations et au pire de pertes de connaissance[10].
Notes et références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) K. H. Butler et O. Mass, « HYDROGEN DISULFIDE », dans Journal of the American Chemical Society, vol. 52, no 6, 1930, p. 2184-2198 [lien DOI (page consultée le 24 février 2010)]
- (en) « The Dipole Moments and Structures of Certain Compounds of Sulfur, Selenium and Phosphorus », dans Journal of the American Chemical Society, vol. 62, no 5, 1940, p. 1219-1223 [lien DOI (page consultée le 24 février 2010)]
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, 2009, 90e éd., Relié, 2804 p. (ISBN 978-1-420-09084-0)
- Erreur dans la syntaxe du modèle ArticleDavies, D. W., « Photoelectron spectra of hydrogen peroxide and hydrogen disulfide: ab initio calculations », dans Chemical Physics Letters, vol. 28, no 4, p. 520–522
- P. Lazzeretti and R. Zanasi, « On the calculation of parity-violating energies in hydrogen peroxide and hydrogen disulfide molecules within the random-phase approximation », dans Chemical Physics Letters, vol. 279, no 5-6, 1997, p. 349–354
- (en) A. K. De, A Text Book of Inorganic Chemistry (ISBN 978-81-224-1384-7) [lire en ligne]
- Walton and Parson, « Preparation and Properties of the Persulfides of Hydrogen », dans J. Amer. Chem. Soc., vol. 43, 1921, p. 2539–48
- Hazardous Reagents, Robinson Brothers
- (en) G Stein, Wilkinson, Seminars in general adult psychiatry, Londres, Royal College of Psychiatrists, 2007, 2e éd. (ISBN 978-1-904671-44-2)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Hydrogen disulfide » (voir la liste des auteurs)
Wikimedia Foundation. 2010.
