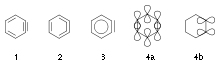- Aryne
-
En chimie, un aryne est un intermédiaire neutre qui dérive d'un arène par abstraction de deux substituants en ortho, laissant 2 orbitales avec deux électrons partagés entre eux[1],[2]. Comme les carbènes et les nitrènes, un aryne possède état singulet et un état triplet.
L'aryne, C6H4 (molécule 1 dans la figure de droite), est souvent nommé benzyne. Pourtant, cette appellation est controversée parce qu'elle sous-entend une liaison triple qui serait un cas particulier de liaison triple. Il est donc préférable de le nommer didéshydrobenzène. Le benzyne est, tout comme le benzène, stabilisé par résonance entre les structures 1 and 2 — ainsi, comme pour le benzène, il serait préférable d'utiliser la représentation 3. La liaison pi « supplémentaire » (4b) est localisée et orthogonale aux autres liaisons pi qui forment le noyau aromatique (4a). Le benzyne peut aussi se représenter comme un diradical : la liaison pi 4b est scindée de façon homolytique, laissant un électron sur chacun des deux atomes qui forment formellement cette liaison. [citation nécessaire]
Le benzyne est une espèce formidablement réactive eu égard à la nature de sa liaison triple. Pour les acétylènes (tels que le plus simple d'entre eux, l'éthyne) les orbitales p non hybridées sont parallèles entre elles, de part et d'autre de l'axe de la molécule. Ceci facilite un recouvrement orbitalaire optimal. En revanche, pour le benzyne, les orbitales sont déformées pour accomoder la triple liaison dans le cycle, ce qui réduit le recouvrement. Le cyclopentadiène sert souvent pour pièger le benzyne.
Il existe trois didéhydrobenzènes diradicaux possibles : 1,2-didéhydrobenzène, 1,3-didéhydrobenzène and 1,4-didéhydrobenzène. Leurs energies in silico sont respectivement 106, 122, et 138 kcal/mol (444, 510, et 577 kJ/mol)[3]. L'espèce 1,4-diradicale a été identifiée dans la cyclisation de Bergman. Jones Maitland, professeur à l'Université de Princeton a étudié l'interconversion des 1,2-, 1,3- et 1,4-didéhydrobenzènes[3],[4].
L'existence des arynes a été postulée pour la première fois par Georg Wittig en 1940 [5],[6],[7] et par Roberts en 1953[8],[9],[10],[11],[12].
Chimie des arynes
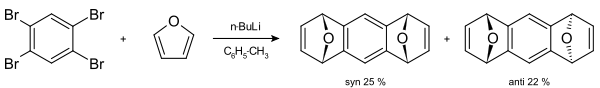
Les arynes sont couramment formés à partir d'halogénures d'aryles en présence de base forte. Les réactions les plus répandues mettant en jeu des arynes sont des réactions de Diels-Alder. Un exemple classique est celui de la synthèse du 1,2,3,4-tetraphénylnaphthalène[13].
Notes et références
- Gilchrist T.C.; Rees C.W.; (1969) Carbenes, Nitrenes and Arynes Nelson. London.
- The Benzyne and Related Intermediates. H. Heaney Chem. Rev., 1962, 62 (2), pp 81–97 DOI:10.1021/cr60216a001
- A m-Benzyne to o-Benzyne Conversion Through a 1,2-Shift of a Phenyl Group. Blake, M. E.; Bartlett, K. L.; Jones, M. Jr. J. Am. Chem. Soc. 2003, 125, 6485. DOI:10.1021/ja0213672
- A p-Benzyne to m-Benzyne Conversion Through a 1,2-Shift of a Phenyl Group. Completion of the Benzyne Cascade, Polishchuk, A. L.; Bartlett, K. L.; Friedman, L. A.; Jones, M. Jr. J. Phys. Org. Chem. 2004, Volume 17, Issue 9 , Pages 798 - 806. DOI:10.1002/poc.797
- Wittig, G., Pieper, G. and Fuhrmann, G. (1940), Über die Bildung von Diphenyl aus Fluorbenzol und Phenyl-lithium (IV. Mitteil. über Austauschreaktionen mit Phenyl-lithium). Berichte der deutschen chemischen Gesellschaft (A and B Series), 73: 1193–1197. DOI:10.1002/cber.19400731113
- Phenyl-lithium, der Schlüssel zu einer neuen Chemie metallorganischer Verbindungen Georg Wittig Naturwissenschaften, 1942, Volume 30, Numbers 46-47, Pages 696-703 DOI:10.1007/BF01489519
- Wittig, G. (1954), Fortschritte auf dem Gebiet der organischen Aniono-Chemie. Angewandte Chemie, 66: 10–17. DOI:10.1002/ange.19540660103
- REARRANGEMENT IN THE REACTION OF CHLOROBENZENE-1-C14 WITH POTASSIUM AMIDE John D. Roberts, Howard E. Simmons Jr., L. A. Carlsmith, C. Wheaton Vaughan J. Am. Chem. Soc., 1953, 75 (13), pp 3290–3291 DOI:10.1021/ja01109a523
- The Mechanism of Aminations of Halobenzenes John D. Roberts, Dorothy A. Semenow, Howard E. Simmons Jr., L. A. Carlsmith J. Am. Chem. Soc., 1956, 78 (3), pp 601–611 DOI:10.1021/ja01584a024
- Orientation in Aminations of Substituted Halobenzenes John D. Roberts, C. Wheaton Vaughan, L. A. Carlsmith, Dorothy A. Semenow J. Am. Chem. Soc., 1956, 78 (3), pp 611–614 DOI:10.1021/ja01584a025
- Modern Arylation Methods. Edited by Lutz Ackermann 2009 WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim ISBN 978-3-527-31937-4
- The Benzyne and Related Intermediates. H. Heaney Chem. Rev., 1962, 62 (2), pp 81–97 DOI:10.1021/cr60216a001
- Organic Syntheses, Coll. Vol. 10, p.678; Vol. 75, p.201 Article
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Aryne » (voir la liste des auteurs)
-
Wikimedia Foundation. 2010.