Acide disulfurique
- Acide disulfurique
-
| Acide disulfurique |
|
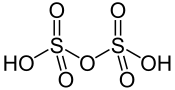
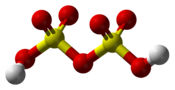
Structure de l'acide disulfurique |
| Général |
| Synonymes |
acide pyrosulfurique, oléum |
| No CAS |
7783-05-3 |
| No EINECS |
231-976-8 |
| PubChem |
62682 |
| ChEBI |
29211 |
| SMILES |
|
| InChI |
InChI : Vue 3D
InChI= 1S/ H2O7S2/ c1- 8( 2, 3) 7- 9( 4, 5) 6/ h( H, 1, 2, 3)( H, 4, 5, 6)
InChIKey :
VFNGKCDDZUSWLR- UHFFFAOYSA- N
|
| Propriétés chimiques |
| Formule brute |
H2O7S2
|
| Masse molaire[1] |
178,142 ± 0,012 g·mol-1
H 1,13 %, O 62,87 %, S 36 %,
|
| pKa |
-3,1 |
| Propriétés physiques |
| T° fusion |
35 °C |
| Masse volumique |
1,9 g·cm-3 |
| Précautions |
|
Directive 67/548/EEC[2]
|
Oléum :

C
|
|
Numéro index :
016-019-00-2
Classification :
R14 - C; R35 - Xi; R37
Symboles :
C : Corrosif
Phrases R :
R14 : Réagit violemment au contact de l’ eau.
R35 : Provoque de graves brûlures.
R37 : Irritant pour les voies respiratoires.
Phrases S :
S26 : En cas de contact avec les yeux, laver immédiatement et abondamment avec de l’ eau et consulter un spécialiste.
S30 : Ne jamais verser de l’ eau dans ce produit.
S45 : En cas d’ accident ou de malaise, consulter immédiatement un médecin ( si possible, lui montrer l’ étiquette).
(S1/2) : Conserver sous clef et hors de portée des enfants.
|
| Phrases R : 14, 35, 37, |
| Phrases S : (1/2), 26, 30, 45, |
|
Transport[2]
|
Oléum :
Code Kemler :
X886 : matière très corrosive et toxique, réagissant dangereusement avec l' eau)
Numéro ONU :
1831 : ACIDE SULFURIQUE FUMANT
Classe :
8
Étiquettes :
 8 : Matières corrosives
8 : Matières corrosives
 6.1 : Matières toxiques
Emballage :
Groupe d
6.1 : Matières toxiques
Emballage :
Groupe d' emballage I : matières très dangereuses;
|
|
SGH[2],[3]
|
Oléum :

Danger
H314, H335, EUH014, P261, P280, P305, P310, P338, P351,
H314 : Provoque de graves brûlures de la peau et des lésions oculaires
H335 : Peut irriter les voies respiratoires
EUH014 : Réagit violemment au contact de l'eau
P261 : Éviter de respirer les poussières/fumées/gaz/brouillards/vapeurs/aérosols.
P280 : Porter des gants de protection/des vêtements de protection/un équipement de protection des yeux/du visage.
P305 : EN CAS DE CONTACT AVEC LES YEUX:
P310 : Appeler immédiatement un CENTRE ANTIPOISON ou un médecin.
P338 : Enlever les lentilles de contact si la victime en porte et si elles peuvent être facilement enlevées. Continuer à rincer.
P351 : Rincer avec précaution à l’eau pendant plusieurs minutes.
|
|
Unités du SI & CNTP, sauf indication contraire.
|
L’acide disulfurique, également appelé acide pyrosulfurique, est un composé chimique de formule H2S2O7. C'est un oxoacide sulfurique, en équilibre avec l'acide sulfurique (H2SO4) et l'eau (H2O) dans les solutions d'acide sulfurique anhydre, et avec l'acide sulfurique et le trioxyde de soufre (SO3) dans l'oléum :
- 2 H2SO4
 H2O + H2S2O7,
H2O + H2S2O7,
- H2SO4 + SO3
 H2S2O7,
H2S2O7,
ce second équilibre étant celui par lequel on réalise sa préparation.
L'acide disulfurique peut être vu comme l'analogue d'un anhydride d'acide pour l'acide sulfurique. Il est suffisamment fort pour protoner l'acide sulfurique anhydre. Il existe des sels d'acide disulfurique, tels que le pyrosulfate de potassium (K2S2O7).
Parmi les acides répondant à la formule générique H2O·(SO3)n, seuls les deux premiers termes ont pu être caractérisés jusqu'à présent : l'acide sulfurique, correspondant à n = 1, et l'acide disulfurique, pour n = 2 ; les termes correspondant à n ≥ 3 n'ont jamais été isolés.
Notes et références
- ↑ Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- ↑ a, b et c Entrée de « Oleum » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 26 mars 2011 (JavaScript nécessaire)
- ↑ SIGMA-ALDRICH
Wikimedia Foundation.
2010.
Contenu soumis à la licence CC-BY-SA. Source : Article Acide disulfurique de Wikipédia en français (auteurs)
Regardez d'autres dictionnaires:
Acide sulfurique — Pour les articles homonymes, voir Acide sulfurique (homonymie). Acide Sulfurique … Wikipédia en Français
Acide fort — Un acide fort est un acide qui, en solution aqueuse, se dissocie totalement en un proton H+ et une base très faible dite base conjuguée de l acide. Sommaire 1 Définition 2 Utilisations des acides forts 3 … Wikipédia en Français
SULFURIQUE (ACIDE) — Déjà connu il y a huit cents ans sous le nom d’«esprit de vitriol», l’acide sulfurique est essentiellement un produit de l’industrie. Toutefois, sa présence est signalée dans certains torrents volcaniques de l’Amérique du Sud. Dans les sols,… … Encyclopédie Universelle
Oxoacide de soufre — Les oxoacides de soufre sont des composés chimiques qui contiennent du soufre, de l oxygène et de l hydrogène. Ce sont des acides inorganiques. Le plus connu par son importance industrielle est l acide sulfurique. Le soufre entre dans la… … Wikipédia en Français
Superacide — Un superacide est un composé chimique plus acide que l’acide sulfurique pur à 100 %, selon une définition de R. J. Gillespie publiée dans les années 1960[1]. Le terme superacide a été utilisé pour la première fois par N. F. Hall et J. B.… … Wikipédia en Français
Trioxyde de soufre — Trioxyde de soufre … Wikipédia en Français
Oléum — Oléum … Wikipédia en Français
Procédé de contact — Le procédé de contact est le mode de production industrielle d acide sulfurique concentré actuellement le plus employé dans le monde. Il consiste essentiellement à catalyser, aujourd hui par pentoxyde de vanadium V2O5, l oxydation de dioxyde de… … Wikipédia en Français
Pyrosulfate — Structure de l anion disulfate. Un pyrosulfate, ou disulfate selon la dénomination recommandée par l IUPAC[1], est un composé chimique contenant l anion de formule brute S2O72 . Sa str … Wikipédia en Français







