- Électrode au calomel saturée
-
Électrode au calomel saturée en KCl
L'électrode au calomel saturée en KCl, ou ECS, est une électrode de référence très utilisée en pratique.
Sommaire
Composition
L'électrode au calomel saturée (en KCl) est composée de mercure métallique (Hg) en contact avec du calomel
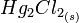 lui-même en équilibre avec une solution de chlorure de potassium (KCl) saturée [1].
lui-même en équilibre avec une solution de chlorure de potassium (KCl) saturée [1].Elle est symbolisée par
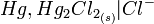 (solution KCl saturée).
(solution KCl saturée).Elle fait intervenir les réactions suivantes [2]:
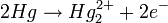
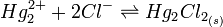
Soit:
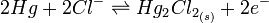
Elle fait donc intervenir le couple redox
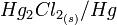 .
.Intérêt
Le potentiel pris par l'électrode dépend uniquement de la concentration en ions chlorures. Le potentiel de l'électrode au calomel est donc fixé par la concentration de la solution de KCl dans laquelle elle baigne: concentration molaire, décimolaire, ou saturée.
Le potentiel de l'ECS à 25 °C par rapport à l'électrode normale à hydrogène est : E = 0,248V [1]
Une telle électrode (ou demi-pile) sert en particulier, comme toutes les électrodes de référence, à déterminer le potentiel électrochimique (inconnu) d'une autre demi-pile.
Théorie
La demi-équation d'oxydo-réduction associée au couple
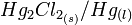 est
est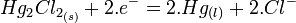
L'équation de Nernst qui en dérive est
![E_{ref} = E^\circ (Hg_2Cl_2/Hg) - \frac{R.T}{2.F}\ln{a(Cl^-)^2}
\approx E^\circ (Hg_2Cl_2/Hg) - 0,059\log{\left( \frac{\left[Cl^-\right]}{C^\circ} \right)}](/pictures/frwiki/55/7492a11cb856c103abec57334337ded2.png)
où le potentiel standard vaut
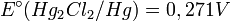 .
.Dès qu'il y a précipitation du chlorure de potassium, l'équilibre
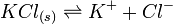
est réalisé.
Ainsi, la loi d'action de masse (ou loi de Guldberg et Waage), donne:
![K_s(KCl_{(s)})=7,0=a(K^+)_{sat}.a(Cl^-)_{sat}=a(Cl^-)_{sat}^2
=\left( \frac{\left[Cl^-\right]}{C^\circ} \right) ^2](/pictures/frwiki/53/5c3cb3be4ebc65d732a55c4d6ace4c75.png)
et donc la concentration en Cl- est fixée:
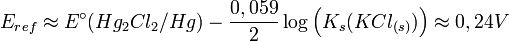
Précautions
Lors de l'utilisation de cette électrode de référence, il faut prendre garde à ce que les ions de la solutions à doser ne viennent, le cas échéant, pas réagir avec les ions chlorure du KCl saturé et former un précipité dans le corps de l'électrode. Pour ce faire, on rajoute un embout rempli de nitrate de potassium, appelé allonge, sur l'électrode. S'il n'y a pas d'allonge disponible, on peut aussi faire tremper l'ECS dans un bécher rempli d'une solution de chlorure de potassium, mettre la seconde électrode dans le bécher où se trouve la solution dont on veut suivre l'évolution et relier les deux par un pont imbibé d'une solution conductrice.
Notes et références
- Portail de la chimie
Catégorie : Électrochimie
Wikimedia Foundation. 2010.

