- Bacteriophage
-
Bactériophage
Un bactériophage (ou phage) est un virus n'infectant que des bactéries. En grec, phageton signifie nourriture/consommation. On les appelle également virus bactériens. Ce sont des outils fondamentaux de recherche et d'étude en génétique moléculaire. Les bactériophages servent entre autres, de vecteurs de clonage de gènes.
Les bactériophages sont présents dans l'ensemble de la biosphère. En effet, ils sont présents partout, mais en quantité plus importante dans les excréments, le sol et les eaux d'égout. La découverte des bactériophages se fait en 1915 par Frederick W. Twort (à Londres) qui remarque que des colonies de microcoques prenaient parfois un aspect vitreux, dû à une destruction des cellules bacteriennes, et que cette caractéristique était transmissible à des colonies normales par simple contact. Puis Félix d'Hérelle fait la même observation dans des selles de malades atteints de dysenterie bacillaire (maladie du colon). Le support génomique des bactériophages peut être un ADN ou un ARN.
Sommaire
Caractéristiques
Constitution
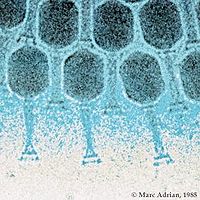
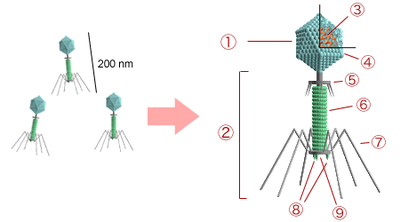
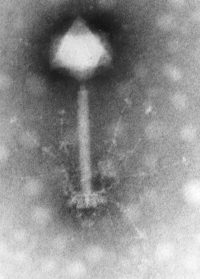
Comme les virus qui infectent les eucaryotes, les phages sont constitués d'une enveloppe protéique externe (appelée capside) protégeant le matériel génétique (ADN ou ARN). Pour plus de 95 % des phages connus, ce matériel est une molécule d'ADN double-brin d'une taille de 5 à 650 kpb et leur taille varie de 24 à 200 nm.
L’organisme responsable de la nomenclature et de la taxonomie des virus s’appelle l’International Commitee on Taxonomy of Viruses (ICTV). On dénombre 21 morphologies différentes chez les virus bactériens actuellement reconnus par l'ICTV. En 2000, plus de 5000 bactériophages différents avaient été observés et décrits. Plus de 95 % d'entre eux possédaient une queue impliquée dans l'entrée de l'ADN du phage dans la cellule bactérienne.
Dans les années 1940, les travaux effectués sur les bactériophages ont permis de découvrir que les acides nucléiques étaient les principaux constituants du matériel génétique. C'est avec cette découverte que prit naissance le vaste domaine de la biologie moléculaire.
Caractérisation
On caractérise les phages par la présence de plage de lyse. L'infection d'une cellule par un seul phage provoque, au bout d'une vingtaine de minutes la lyse de la cellule bactérienne avec libération de centaines de particules phagiques. Chaque particule de la descendance va aller infecter une bactérie voisine et recommencer le cycle lytique. Assez vite, le résultat de ces destructions en cascade devient visible à l'œil nu sous forme de trous dans le tapis bactérien appelés des plages de lyse. Ces plages de lyse constituent un phénotype permettant de caractériser les phages.
Reproduction
Les phages sont en général spécifiques et ne peuvent infecter qu'une seule espèce de bactérie. Ceci est en particulier lié à leur mécanisme de pénétration dans la cellule bactérienne : les phages reconnaissent en effet une protéine spécifique de la surface bactérienne, leur "récepteur", qui leur permet de s'accrocher et d'injecter leur matériel génétique. Ce récepteur varie d'un phage à l'autre et dépend de l'espèce bactérienne ciblée.
Le cycle de réplication des phages dans la cellule peut suivre plusieurs schémas :
- Certains phages sont virulents ou lytiques, c'est-à-dire qu'aussitôt qu'ils infectent une cellule, la réplication démarre, de nouveaux virions sont assemblés et produit et, dans un court laps de temps, des protéines virales provoquent la lyse de la cellule hôte et la libération de nombreux nouveaux phages. Le microbiologiste Mark Müller a dit : « Les bactéries ne meurent pas, elles explosent en multiples phages. »
- Certains bactériophages (appelés phages tempérés) peuvent demeurer dans un état quiescent en intégrant leur matériel génétique à l'ADN de la bactérie. On parle alors de provirus ou de prophage, c'est-à-dire un virus dont le matériel génétique est intégré au génome de l'hôte. Ces phages endogènes, sont copiés à chaque division cellulaire avec l'ensemble de l'ADN de la bactérie, que l'on qualifie alors de lysogène. Pendant cette phase de latence, l'expression des gènes codés par le génome du phage est en général réprimée par une protéine répresseur. Dans certaines conditions, en particulier en cas de carence ou de stress, le prophage sort de sont état quiescent et active son cycle réplicatif. Il s'excise du génome de l'hôte et entre dans un cycle lytique, comme ci-dessus. Parfois, les prophages apportent quelque chose à la relation bactérie-phage quand la cellule est en dormance, en ajoutant de nouvelles fonctions au génome de la bactérie, un phénomène appelé conversion lysogène. Un exemple connu est l'inoffensive bactérie Vibrio qui, quand elle est lysogénisée par un phage, cause le choléra.
- Certains phages ne provoquent pas la lyse de la cellule infectée, mais bourgeonnent à la membrane bactérienne, sans la rompre. C'est le cas des phages filamenteux comme M13 ou f1 d'Escherichia coli. La cellule infectée devient alors une usine à produire du phage de manière continue.
Cycles lytique et lysogénique
Les bactériophages, ubiquitaires de nature, persistent dans le monde bactérien sous deux états distincts : en tant que phage virulent (qui se réplique dans une cellule bactérienne réceptive) ou sous forme lysogène (inséré dans le génome sous la forme d’un prophage, il devient partie intégrante du génome de l’hôte). Tous les virus bactériophages ont un cycle lytique (infectieux) pendant lequel le virus, incapable de se reproduire par ses propres moyens, injecte son matériel génétique dans la bactérie. Grâce aux enzymes et aux ribosomes de l'hôte, le virus peut être répliqué à plus de cent exemplaires avant que l'hôte n'éclate. Mais parfois, certains bactériophages se comportent autrement. Leur matériel génétique s'intègre au chromosome de la bactérie qui le transmet à ses descendants (lysogénie). Dans un cas pour cent mille, l'ADN viral est activé et entame un cycle lytique.
Les bactériophages participent à l'évolution des bactéries
Comme les phages peuvent porter dans leur génome des gènes accessoires à leur cycle de vie, ils participent aux transferts horizontaux de gènes entre populations bactériennes. C'est la transduction. Lorsque ces gènes accessoires codent des facteurs de virulence, la bactérie infectée voit son pouvoir pathogène augmenté – c’est le phénomène de « conversion lysogénique ».
Un exemple bien connu est celui des gènes des toxines Stx des Escherichia coli entérohémorragiques (EHEC). Ces gènes stx sont localisées dans des séquences de bactériophages lambdoïdes intégrés dans le chromosome. Les EHEC auraient donc émergé par conversion lysogénique. On connaît de nombreux autres exemples de ce type, comme la toxine cholérique de Vibrio cholerae qui est portée par le phage CTX.
Les bactériophages lysogènes sont souvent intégrés dans le chromosome au niveau de loci codant des ARN de transfert (ARNt). Par exemple, le phage ¨PhiR73 de Escherichia coli est inséré au niveau du locus selC. L'acquisition de gènes étrangers par transfert horizontal, grâce à des bactériophages s’intégrant au niveau de tels « points chauds » est plausible, puisque les séquences codant les ARNt sont hautement conservées entre les différentes espèces bactériennes. Enfin, la persistance des gènes de virulence dans les génomes phagiques suggère qu’ils confèrent un avantage sélectif, peut-être dû à la plus grande multiplication et diffusion de la bactérie hôte.
Les bactériophages comme outil fondamental de recherche
Les phages ont permis l'essor de la biologie moléculaire
Dans les années 1960, des recherches de pointe menées sur les mécanismes hôte/phage par des physiologistes américains, Max Delbrück, Alfred Hershey et Salvador Luria, valurent à ces chercheurs le prix Nobel de médecine-physiologie en 1969.
Article détaillé : expérience de Delbrück et Luria.Les phages ont permis différentes découvertes:
- L'expérience de Hershey et Chase qui a permis de confirmer la fonction de l'ADN en tant que support de l'information génétique. Hershey et Chase incorporèrent du phosphate 32 dans l'ADN d'une culture de phage et du soufre 35 dans les protèines d'une autre culture de ce même phage. Puis, ils utilisèrent chacune de ces culture de phage indépendamment pour infecter E.Coli à raison d'un nombre élevé de particules virales par cellule bactérienne. Après un temps suffisant pour que l'infection ait eu lieu, ils détachèrent les enveloppes vides des phages (ghosts) des cellules bactériennes par agitation mécanique. Par centrifugation, ils séparèrent les cellules bactériennes des ghosts et mesurèrent la radioactivité des deux fractions obtenues. En utilisant les phages marqués au 32P, la majeure partie de la radioactivité aboutissait dans les cellules bactériennes, indiquant que l'ADN de phage entre dans les cellules. Au contraire, le 35S restait dans les ghosts montrant que les proteines du phage n'avaient jamais pénétré dans la cellule bactérienne. Conclusion: l'ADN est le materiel héréditaire tandis que les proteines de phages ne sont qu'un emballage qui est eécarté une fois que le précieux ADN a été injecté dans la cellule bactérienne.
- En 1980, le biochimiste britannique Frederick Sanger reçut le prix Nobel pour avoir réussi à séquencer l'ADN en utilisant un phage. Le premier organisme biologique dont le génome a été séquencé est un phage ( intérêt étant du à son ADN simple brin). Protocole de la méthode de séquencage: incubation de l'ADN à séquencer avec une amorce, le fragment de Klenow (ADN pol I depourvue d'activité exonucléasique 5'→3'), les 4 désoxyribonucléotides (dNTP) et 1 didésoxyribonucléotide (ddNTP) en faible concentration. Le ddNTP induit l'arret de l'élongation: tous les fragments obtenus se termineront par ce nucléotide. Puisqu'il est utilisé en faible concentration, on va obtenir des fragments de tailles différentes. On refait l'experience avec les 4 ddNTP. Les fragments sont séparés par electrophorese sur gel de polyacrilamide.
- Les 1eres experiences suggerant un ARN intermediaire dans la synthese proteique. Il s'agit de l'experience de E. Volkin et L. Astrachan en 1957. Ils font une experience de pulse chase dans laquelle l'ARNm est marqué de facon spécifique avec de l'uracile radioactif. Ils constatent que l'infection par un bacteriophage T2 induit une augmentation de la quantité d'ARNm dans la cellule hote et que cet ARNm a un temps de vie tres court (car tres vite degradé après le marquage). Conclusion: l'ARN joue un rôle intermediaire entre l'ADN et les proteines.
- La decouverte des enzymes de restriction en 1962 par W. Arber. Prococole de l'expèrience: On infecte 2 souches bacteriennes A et B par un phage X puis on récupère le lysat de phage pour l'utiliser dans une nouvelle infection dans les deux souches bacteriennes utilisées précédemment. Résultat: le phage X-A peut infecter les 2 souches bacteriennes alors le phage X-B ne peut pas infecter la souche A. Conclusion: les phages ont une spécificité d'hote qui dépend de la souche dans lequel il s'est développé et pas de son génotype. Cette restriction d'hote est du a la méthylation de l'ADN par des enzymes spécifiques permet de protéger l'ADN viral de la degradation par des nucléases de la bactérie. Ces nucléases sont enfaite des enzymes de restriction qui ne reconnaissent que la forme non méthylé de leur site de coupure. L'enzyme nécessaire a cette méthylation n'est présente que dans la souche A donc seul le phage X-A est méthylé donc seul lui n'est pas degradé par les nucléases. Ce mécanisme permet a la bacterie de differencié son propre ADN de l'ADN etranger.
- La recherche en génétique sur la structure des génomes par Benzer. Celui ci à déterminer la structure fine des genes grâce à l'étude de recombinaisons entre mutants de bactériophage T4. Les bactériophages présentent deux avantages énormes : la fréquence de recombinaison est élevée, la descendance est quasi illimitée ce qui permettra d'avoir accès à des événements très rares.
L'étude des phages a des implications importantes en médecine et en génétique, en particulier pour la compréhension des infections virales, des anomalies génétiques, de l'embryologie humaine, des causes du cancer et de la résistance des bactéries aux antibiotiques.
Utilisation en génie génétique
Les phages sont utilisés de multiples manières dans la biologie moléculaire. Ils sont utilisés comme vecteurs de clonage pour insérer de l'ADN dans les bactéries. La méthode du phage display est une méthode qui permet la sélection d'un peptide grâce à sa présentation sur la surface de phages. Le phage display constitue une catégorie de phage permettant la construcution de banques d'ADN ou d'ADN complémentaire. Les 2 principaux phages utilisés dans cette technique sont les phages M13 (phage filamenteux) et lambda qui infectent tous les 2 E.Coli. Prenons l'exemple du phage M13 qui est un phage filamenteux capable d'infecter uniquement les bactéries gram (-) ayant incorporé le facteur F et dont l'infection conduit à la lysogénie. Sa capside contient, entre autres, les proteines P8 et P3 nécessaire pour la liaison du bactériophage à la bactérie via les pilis sexuels. Ces 2 proteines vont être utilisé pour présenter à la surface des phages des molécules d'intérêt (peptide, fragment d'anticorps ou proteine entiere): On va faire fusionner notre molécule d'intérêt avec les proteines P7 et P3, pour cela il faut inserer le gène codant la molécule d'intérêt à proximité de l'extrémité 5' des genes P3 et P7 en respectant le cadre de lecture. On utilise l'une ou l'autre des proteines selon le type de molécule et la quantité de molécules qu'on veut exposer à la surface du phage. On distingue les phages polyvalent/homogene, où toutes les proteines P3 et P7 sont fusionnées, des phages monovalents/hétérogene ou seulement une partie des proteines le sont. Intérêt de la technique: elle permet d'obtenir des banques d'ADN qu'on peut facilement conserver et les clones sélectionnés sont multipliés à faible coût. Cette technique va permettre de produire des anticorps sans devoir passer par l'immunisation d'un animal. Limite de la technique: certaines molécules ne peuvent pas être exprimées comme par exemple les molécules toxiques pour la cellule hôte. Il y a donc une capacité limiter à transformer E.Coli.
Utilisation dans le séquençage de génomes entiers
Le séquençage d'un génome ne se fait pas d'un seul coup, mais petit à petit sur des fragments de génomes. Pour cela ces fragments d'ADN doivent être stockés et multipliés dans des organismes servant de banque d'ADN. Les phages en tant que vecteurs de clonage le permettent.
Article détaillé : Projet génome humain.Utilisation des phages en tant qu'agent anti-microbien
- Les phages detruisent les bacteries en s'y reproduisant massivement, on peut donc les utiliser dans la lutte contre les bactéries resistantes aux antibiotiques. On parle donc de phagothérapie. Les bactériophages ont été decouverts avant les antibiotiques mais ce sont ces derniers qui ont été retenus en tant que thérapie anti bactérienne car ce sont des molécules inertes clairement définies et pour lesquels on maitrise parfaitement les méthodes de préparation contrairement aux bactériophages qui sont eux des êtres vivants. Mais aujourd'hui les phages reviennent de plus en plus au devant de la scène justement à cause du développement important de résistances bactériennes face aux antibiotiques. Ils sont utilisés seulement en Géorgie et en Pologne par 2 cliniques, mais contrairement à l'avis de certains occidentaux qui pensaient que "le suivi des patients y est insuffisants pour qu'on puisse en tirer des publications scientifiques rigoureuses" (tel que cela fut écrit dans la version antérieure de cet article), il existe bel et bien des publications médicales minutieuses et fiables, sur divers traitements effectués sur suffisamment d'années et de patients. Mais comme il s'agit d'articles en russe ou en géorgien, ils sont rarement connus des médecins occidentaux. Ils sont pour la plupart disponibles à la bibliothèque de l'Eliava Institute[1], ainsi que dans quelques bibliothèques universitaires des pays de l'Est ou de l'ex-URSS.
- En 2006, aux États-Unis, une préparation à base de six virus bactériophages a été autorisée comme conservateur alimentaire, notamment, pour lutter contre la listériose.
Utilisation en Médecine
En ex-URSS et plus particulièrement en Géorgie et en Pologne, les phages sont utilisés pour traiter les infections bactériennes avec ou sans adjonction de traitement antibiotique. Dans de nombreux cas, les phages sont aussi efficaces que les antibiotiques et souvent même supérieurs, notamment dans les cas d'infections chroniques. [3] [4]
Néanmoins, il est parfois émis qu'à l'instar des antibiotiques, ce traitement pourrait participer à la sélection de souches bactériennes résistantes, faisant que l'on pourrait éventuellement craindre à terme que certaines bactéries soient insensibilisées à certaines phagothérapies, comme à l'antibiothérapie. Pour autant, ce raisonnement ne saurait interdire l'utilisation des "phages", auquel cas il faudrait également abandonner les antibiotiques. En outre, bien qu'il soit partiellement fondé, cet argument est à relativiser du fait que les bactériophages co-évoluent naturellement de manière presque synchrone face aux résistances des bactéries, ce qui n'est pas le cas des antibiotiques. De ce fait, si leur utilisation est bien encadrée, elle constitue une piste sérieuse dans la découverte de traitements durables contre les infections bactériennes.
Liste des principaux bactériophages
- phage λ - lysogène
- phage T4 (169 à 170 kilopaires de bases, 200 nm de long)
- phage T5
- phage T7
- phage R17 - Le prototype des phages à ARN. L'un des virus les plus simples connus.
- phage M13 - Phagemid
- phage ϕX174 - phage à ADN simple brin, le premier organisme dont le génome aie été séquencé.
Voir aussi
"Des virus pour combattre les infections" (240 p., 2008, éd. Favre), par le docteur Alain Dublanchet.
- Portail de la microbiologie
- Portail de la médecine
- Portail de la biologie cellulaire et moléculaire
Catégories : Bactériologie | Virus
Wikimedia Foundation. 2010.