- Therapie genique
-
Thérapie génique
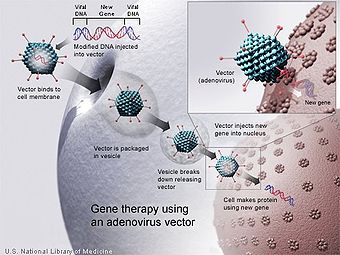 Thérapie génique à base d'un vecteur adénovirus. Un nouveau gène est inséré dans un vecteur dérivé d'un adénovirus, lequel est utilisé pour introduire l'ADN modifié dans une cellule humaine. Si le transfert se déroule correctement, le nouveau gène élaborera une protéine fonctionnelle qui pourra alors exprimer son potentiel thérapeutique.
Thérapie génique à base d'un vecteur adénovirus. Un nouveau gène est inséré dans un vecteur dérivé d'un adénovirus, lequel est utilisé pour introduire l'ADN modifié dans une cellule humaine. Si le transfert se déroule correctement, le nouveau gène élaborera une protéine fonctionnelle qui pourra alors exprimer son potentiel thérapeutique.
La thérapie génique est une stratégie thérapeutique qui consiste à faire pénétrer des gènes dans les cellules ou les tissus d'un individu pour traiter une maladie. La thérapie génique vise à remplacer ou complémenter un allèle mutant défectif par un allèle fonctionnel ou à surexprimer une protéine dont l'activité aurait un impact thérapeutique.
Historique
Le concept de thérapie génique - réparer ou modifier le patrimoine génétique pour traiter une pathologie - est réellement évoqué par la communauté scientifique à la fin des années 1960[1]. Mais si tous les éléments théoriques sont présents, le niveau technologique ne permet pas encore de réaliser pratiquement cette approche. L’amélioration des connaissances concernant les liens entre certains gènes mutés et certaines pathologies, la création de système de transfert de gènes à partir de virus sécurisés, l’amélioration des technologies de manipulation de l’ADN - en bref toutes les avancées de ce tissu de concepts et techniques que l’on appelle aujourd’hui la biotechnologie - permettent à cette idée théorique de voir le jour sous la forme d’un premier essai clinique initié par S. Rosenberg aux États-Unis à la fin des années 1980. Les années 1990 et le début du XXIe siècle voient éclore une kyrielle d’essais cliniques dans des pathologies très diverses : cancer, maladies cardiaques et vasculaires, infections virales, immunodéficiences héréditaires, … associée à un engouement majeur du public (notamment à travers le Téléthon) et des investisseurs. Mal servie par une communication faisant peu la part des choses entre la réalité du terrain et les hypothèses, face à des acteurs industriels ou à des patients qui attendent des résultats positifs immédiats, la thérapie génique est rapidement confrontée au constat amer se dégageant de cette période: aucun bénéfice réel n'est observé pour les quelques 4000 patients enrôlés dans les 400 à 600 essais réalisés durant cette période. Des difficultés de communication entre la communauté scientifique académique et celle de l’industrie, un désengagement progressif des capitaux-risqueurs sur les approches de thérapie génique, une méfiance concernant le réel potentiel de cette stratégie marquent l'entrée de la thérapie génique dans le XXIe siècle. Le succès thérapeutique du protocole de Alain Fischer sur le traitement des enfants-bulles atteints d’immunodéficience sévère dans les années 2000, démontrant formellement l'intérêt du concept mais mitigé par certains effets secondaires graves, ne parvient pas à relancer totalement les efforts des divers acteurs sur ce domaine(cf plus bas). Aujourd’hui, dans une phase plus mature, moins médiatisée, plus réfléchie, plus consciente des nombreuses années - voire décennies - nécessaires pour que cette idée s'inscrive dans une routine thérapeutique, de nombreuses équipes internationales continuent à travailler pour faire de la thérapie génique un outil supplémentaire à la panoplie des traitements hospitaliers.[2]’[3]
Beaucoup de pathologies sont des cibles potentielles de la thérapie génique
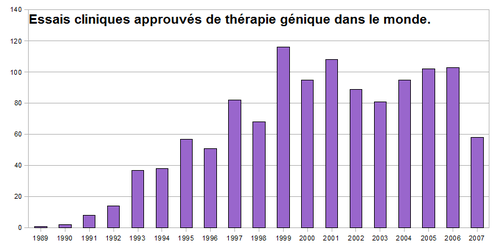
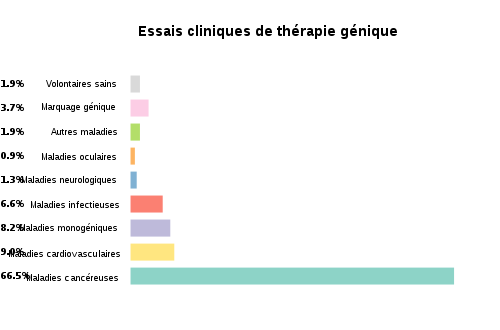
Alors que ce concept est né sur l'idée de traiter des pathologies héréditaires, il s'est rapidement orienté vers le traitement de toutes les affections, héréditaires ou non, dans lesquelles il était possible d'imaginer que certains gènes étaient défectueux ou qu'il était possible d'envisager un rôle pour de nouveaux gènes. Les cancers, les infections virales, la douleur, les affections cardiaques, les atteintes traumatiques du système nerveux, ... Conceptuellement il n'est pas une pathologie qui ne pourrait pas bénéficier d'une approche de thérapie génique, que ce soit par une stratégie de restauration d'une activité génétique défaillante ou par la production d'une activité supplémentaire qui puisse avoir un impact thérapeutique. Pratiquement, depuis le premier essai clinique (qui s'intéressait alors au traitement du cancer), on observe qu'environ 70% des essais se sont focalisés sur le traitement du cancer, environ 20% sur le traitement de maladies héréditaires classiques, et 10% sur des affections diverses comme les infections virales. Environ 1400 essais cliniques auraient été réalisés au niveau international.[4] Si le jeu des statistiques est tentant, il faut toutefois se garder de tirer des conclusions claires de l'analyse globale de ces protocoles qui s'intéressent à des pathologies, des technologies et des concepts très diversifiés.
Transporter un gène: la problématique des vecteurs en thérapie génique
Une fois le gène sélectionné pour son potentiel thérapeutique face à une pathologie, une étape cruciale de la thérapie génique est de faire pénétrer la nouvelle information génétique dans l'organisme du patient. Dans cet esprit, est qualifié de vecteur de thérapie génique tout système permettant le transfert de ce gène dans une cellule. Les vecteurs utilisés en thérapie génique, et les cellules modifiés génétiquement par ces vecteurs sont classifiés comme des Organismes Génétiquement Modifiés. Les patients traités ne sont pas considérés dans cette classification selon une directive européenne qui en exclut les humains d'office[5].
Vecteurs viraux
L'utilisation de virus modifiés pour transporter un gène thérapeutique repose sur le constat d'efficacité des virus pour transférer leur propre matériel génétique dans les cellules humaines. Pour produire des vecteurs viraux, on utilise des virus modifiés génétiquement, dits sécurisés. Le principe consiste à éliminer les séquences du virus qui codent des protéines, notamment celles associées à un éventuel comportement pathogène du virus, et à ne conserver que celles qui sont utilisées pour construire la particule virale et assurer le cycle d'infection. Le génome du virus est reconstruit pour porter les séquences du gène thérapeutique. Les protéines virales qui potentiellement manqueraient à la formation des particules virales thérapeutiques sont fournies par des cellules dites productrices ou d'encapsidation lors de la phase de production des vecteurs.
Vecteurs adénoviraux
L’adénovirus est un virus à ADN. Il présente la caractéristique de faire pénétrer son matériel génétique dans la cellule cible sans attendre la mitose (division cellulaire) et sans insérer la nouvelle information génétique dans le génome de la cellule cible. Bien que très utilisés dans de nombreux essais cliniques, les chercheurs n’arrivent toujours pas à ce jour à le débarrasser complètement de ses gènes, maintenant ainsi un caractère potentiellement pathogène au vecteur construit.[6]
Vecteurs rétroviraux
Les rétrovirus sont utilisés comme vecteur en thérapie génique car ils permettent d'insérer la nouvelle information génétique dans le génome de la cellule cible. Le nouveau gène se transmet alors de cellules mères en cellules filles de manière égale sans « dilution » de l'information génétique dans le temps. Le génome des rétrovirus est composé de molécules d'ARN (acide Ribonucléique) et non d'ADN comme le génome des cellules humaines. L'infection par un rétrovirus implique une étape de rétrotranscription de l'ARN en un fragment d'ADN qui pourra être associé (étape d'intégration) aux chromosomes après pénétration dans le noyau cellulaire. Une combinaison de protéines virales et de protéines de la cellule cible assure cette étape de transfert des molécules d'ADN du cytoplasme cellulaire vers le noyau et l'intégration dans le génome de l'hôte. Une fois intégré, le génome du rétrovirus sous sa forme ADN est stable et transmis de manière mendélienne comme n'importe quel gène de la cellule. Si la plupart des essais cliniques ont été réalisés avec des vecteurs dérivés de rétrovirus de souris, certains essais cliniques sont actuellement en cours utilisant des vecteurs dérivés du virus VIH (traitement de l'adrénoleucodystrophie par l'équipe Cartier-Aubourg à Paris depuis 2007, traitement de l'infection à VIH aux États-Unis depuis 2000), traitement d'hémoglobinopathies par l'équipe Leboulch-Beuzard à Paris. Ce dernier type de vecteur, dit vecteur lentiviral, dérivé d'un virus humain mais totalement sécurisé est un vecteur particulièrement en vogue. En effet, il est capable de modifier génétiquement des cellules au repos, ouvrant ainsi des possibilités de manipuler des neurones, des cellules hépatiques,... toute une gamme de populations cellulaires inaccessible aux vecteurs rétroviraux dérivés de virus murins.[7] L'intégration des vecteurs rétroviraux dans le génome de la cellule cible, si elle est un atout majeur pour la pérennisation et la transmission de l'information génétique, représente néanmoins une difficulté en termes de sécurité. Deux essais cliniques utilisant les vecteurs rétroviraux murins pour modifier les cellules hématopoïétiques (traitement de l'immunodéficience liée à une mutation portée par la chaine gamma-c du récepteur à l'interleukine-2 - voir plus bas - et traitement de la maladie de Gaucher) ont conduit à l'apparition de formes de leucémies chez les patients.
Vecteurs dérivés de l’AAV
Les vecteurs de type AAV (adeno associated virus) sont dérivés de virus dits associés aux adénovirus. Les virus ont la particularité de favoriser une intégration de leur génome toujours au même endroit dans le chromosome 19. Une insertion non contrôlée pouvant entraîner d'importants désordres dans la fonction cellulaire, ces vecteurs ont été fortement développés pour leur potentiel sécuritaire bien qu’ils ne soient capables que de transférer des petits gènes. Bien que la construction du vecteur à partir du virus élimine cette propriété de ciblage de l'insertion, les virus dérivés des AAV ont été beaucoup utilisés au niveau clinique. Longtemps considéré comme inoffensifs, à l'inverse des vecteurs adénoviraux et rétroviraux (voir plus loin), leur développement a été favorisé depuis quelques années.[8] Mais, le décès récent au cours de l'été 2007 d'un patient dans un essai clinique de traitement de la polyarthrite rhumatoïde par des vecteurs dérivés de l'AAV permet aussi désormais aux détracteurs de cette stratégie de pointer le doigt sur ce type de vecteur .[9]
Vecteurs dérivés d’autres virus
Au-delà de ces vecteurs fréquemment utilisés en clinique, de nombreuses tentatives d’utilisation de vecteurs à partir de virus sont décrits dans la littérature. On relèvera de nombreux travaux concernant l’utilisation du virus Herpes Simplex (HSV), des poxvirus (actuellement en développement clinique), de virus animaux apparentés au VIH, du virus de la grippe, …. Ces diverses tentatives témoignent d'une part de l'inexistence d'un vecteur viral universel poussant les scientifiques à tester de nouvelles voies, et d'autre part de la volonté pour certains industriels de se positionner dans le domaine avec des brevets propriétaires.
Vecteurs non viraux
Différentes stratégies ont été élaborées pour ne pas recourir aux virus et utiliser directement la molécule d'ADN.
- La plupart des stratégies combinent des molécules chimiques (polycations, ...) et la molécule d'ADN pou faciliter la traversée de la membrane des cellules et la rentrée des molécules d'ADN. Ces vecteurs produits par des bactéries, facilement purifiables, sont des particules inertes et n'ont pas les caractères potentiellement pathogènes des virus qui sont à l'origine des vecteurs viraux.
A l'inverse des vecteurs viraux, ils sont plus faciles à produire,à manipuler et à stocker et sont caractérisables comme des produits pharmaceutiques classiques. Cependant, leur efficacité est bien moindre que celle des virus pour transférer une information génétique dans une grande population de cellules, rendant difficile leur utilisation dans certains cas (modification d'une grande partie des cellules d'une tumeur par exemple). En outre, ils n'ont qu'une capacité très réduite à intégrer l'information génétique dans le génome, les rendant ainsi inutiles pour des modifications génétiques pérennes de populations cellulaires en prolifération active. Cette technologie peut être cependant parfaitement adaptée à certaines stratégies thérapeutiques reposant sur le déclenchement d'une cascade d'évènements à partir de quelques cellules modifiées génétiquement (activation du système immunitaire, par exemple).
- Récemment, et en laboratoire, des nanoparticules magnétiques (pilotés vers leur cible par des aimants) ont été des vecteurs efficaces d'ARN interférents (ARNi) ici utilisés contre le cancer [10]. Les premiers vecteurs testés étaient des nanocristaux magnétiques recouverts d'une couche de lipides ou de polymères, difficiles à fabriquer.
Plus récemment, une nanoparticule nommée « LipoMag » (nanocristal magnétique enrobé d'acide oléique puis d'une monoouche lipidique cationique a efficacement porté un ARNi anticancéreux (inhibiteur de la croissance des vaisseaux tumoraux), chez des souris atteintes de tumeurs gastriques. Dans 9 cas sur 13, le transfert s'est fait plus efficacement qu'avec les nanocristaux utilisés jusqu'alors [11].
Administration du vecteur
De nombreux essais cliniques de thérapie génique ont utilisé une stratégie de protocole dite "ex vivo", c'est-à-dire en prélevant des cellules cibles de l’individu et en les soumettant aux vecteurs de transfert du gène thérapeutique en dehors de l'organisme. Les cellules sont ensuite réinjectées au patient. Cela permet aux chercheurs dans certains cas d'évaluer l'ampleur de la modification génétique tant au niveau du pourcentage de cellules modifiées génétiquement qu'au niveau de l'expression des protéines thérapeutiques, ou de présélectionner des populations cellulaires particulières (ex.: les cellules souches sanguines). Néanmoins, certaines stratégies, notamment celles visant à éliminer des tumeurs, ou celles visant à modifier génétiquement des cellules qu'on ne peut manipuler hors de l'organisme, utilisent une approche dite in vivo en injectant directement le vecteur dans le tissu ciblé, et en le laissant agir librement.
Des stratégies sans limites
La thérapie génique, comme toutes les approches de biotechnologie, repose sur la recherche fondamentale. Les mécanismes biologiques mis en évidence, et leurs origines génétiques sous-jacentes, permettent d’imaginer des stratégies de réparation ou de supplémentation. La réussite de ces stratégies dépend donc autant des capacités à mettre en place des techniques adéquates (transfert de gène efficace, expression cohérente du gène, …) que de la justesse avec laquelle sont appréhendés les mécanismes en cause. Leur limite ne dépend que de l’imagination de la communauté scientifique et médicale. Dans cet esprit, on peut distinguer plusieurs grandes approches.
Une maladie, un gène muté, la stratégie phare de la thérapie génique
La « réparation » d’une activité génétique est envisagée ou a été testée au niveau clinique dans de nombreuses pathologies. Certaines immunodéficiences liées à des déficits dans le gène codant l’Adénosine Déaminase, ou dans celui codant la chaîne gamma-c du récepteur à l’Interleukine-2 (protocole Fischer, voir ci-dessous) ou les béta-thalassémies caractérisées par des défauts de synthèse de certaines globines permettent d’imaginer la production des protéines manquantes par des cellules hématopoïétiques modifiées génétiquement. Les hémophilies de type A et B sont respectivement associées à des défauts de production des facteurs VIII et IX de la chaîne de coagulation qui pourraient être produites par des cellules musculaires ou hépatiques libérant ces facteurs dans le sang. Le traitement de la mucoviscidose est envisagé par l’expression du gène codant le CFTR (Cystic Fibrosis Transmembrane Conductance Regulator) par certaines cellules pulmonaires.
Une maladie, un contexte génétique mal connu, des « gènes de secours » possibles
Certaines pathologies sont plus complexes en apparence. Ainsi, le traitement de la maladie de Parkinson est abordé de diverses manières dans la mesure où le lien entre la dégénérescence des neurones et une mutation génétique n’est pas clairement établi. Il est par exemple proposé d’exprimer la Décarboxylase de l'acide glutamique (GAD), la Décarboxylase de l'acide aminé aromatique (AADC) ou la Neurturine pour au minimum limiter la dégénérescence.
Le cancer, une maladie à la génétique trop complexe
Le cancer est essentiellement abordé à travers le concept de destruction directe ou indirecte des cellules cancéreuses. De nombreux protocoles cliniques ont été réalisés en insérant dans les cellules cancéreuses des gènes codant des protéines sensibilisant les cellules cancéreuses à des drogues. Ainsi, le gène codant la thymidine kinase du virus Herpes simplex sensibilise les cellules à un produit normalement inoffensif, le ganciclovir. Les cellules cancéreuses sont modifiées directement dans l’organisme en injectant les vecteurs in vivo et le ganciclovir est administré dans un second temps. Reposant plus sur les évolutions de la recherche fondamentale des vingt dernières années, certaines approches proposent d’utiliser des mécanismes de protection naturelle pour éradiquer les cellules cancéreuses. La stimulation du système immunitaire par la surexpression de cytokines (GM-CSF, Interferon, …), ou le rétablissement de chaînes biologiques dite de « mort cellulaire programmées ou apoptose (surexpression de p53, …), font partie de ces stratégies.
Bloquer des processus en transférant un gène
De nombreuses stratégies de blocage biologique ont vu le jour dans les années 90 essentiellement pour contrer l’infection par le VIH. Expression de protéines virales mutées (leurre) interférant avec les protéines naturelles du virus, expression d’ARN anti-sens capables d’inhiber la traduction de protéines virales, expression de molécules de protection naturelle de la cellule (interférons, protéines de déclenchement de l’apoptose, …), … toutes ces stratégies reposent sur une interférence entre les diverses phases du cycle de multiplication du virus et une protéine ou un ARN dont la production est assurée par un vecteur exogène transféré dans les lymphocytes T du patient. Dans un autre domaine, de nombreux groupes travaillent sur l’expression de protéines impliquées dans les mécanismes immunitaires pour bloquer les rejets de greffe (production d’inhibiteur du complément, de cytokines immunosuppressives dérégulant le mécanisme de réponse immunitaire, d’inhibiteurs des interactions entre greffon et cellule immunitaires, …). Bien que peu développées certaines approches s’intéressent également à l’inhibition de la douleur avec par exemple l’expression de la Pre-proenkephaline.
Manipuler le développement
Des approches récentes se sont portées sur l’expression de protéines impliquées dans le développement embryonnaire (protéine NeuroD ou protéine PDX1) pour modifier le statut des cellules hépatiques et les transformer quasiment en cellules pancréatiques afin de redonner au patient diabétiques des cellules capables de produire de manière régulé de l’insuline.
Une réussite mitigée, de nombreux échecs, les premiers effets secondaires
La plupart, sinon la totalité des essais cliniques de thérapie génique depuis le début des années 1990 peuvent être considérés comme des échecs dans la mesure où ils n'ont que très rarement, et que brièvement, amélioré l'état clinique des patients, et ils n'ont jamais aboutit à la mise en place de thérapeutiques reconnues et utilisées au niveau international. Actuellement une seule stratégie, celle employée par Alain Fischer et Marina Cavazzana-Calvo, visant à traiter l'incapacité à développer des réponses immunitaires de nouveau-nés atteints d'immunodéficience sévère (SCID, Severe Combined Immunodeficiency) peut être considérée comme une réussite avec cependant une situation complexe car cette stratégie est parfois à l'origine d'effets secondaires graves. En 1998-99, de très jeunes enfants atteints du SCID-X souffrants d’une immunodéficience (des "bébé bulles") ont reçu un traitement visant à rendre actif leurs lymphocytes T déficients. Plus précisément, la thérapie consistait à insérer un gène fonctionnel restaurant la fonctionnalité d'un récepteur de l’interleukine 2. La mutation de certaines protéines de ce récepteur empêche ces malades de disposer d’une réaction immunitaire efficace les rendant sensibles à toutes les infections opportunistes. Dans un premier temps, l’entreprise s’est révélée être une réussite totale avec la guérison des patients[12]: la plupart des bébés ont pu sortir de leurs bulles et vivre normalement. Cependant, quatre de ces patients sur la vingtaine d'enfants traités par ce type de thérapie ont développé une leucémie après quelques années. De nombreuses données convergent pour penser que le type de vecteur utilisé pourrait s'intégrer dans des régions sensibles du génome, et en dérégulant certains gènes, comme le proto-oncogène LMO2[13] (un gène fréquemment retrouvé activé dans des lymphomes naturels) pourrait participer à ces formes de leucémies induites. On peut corréler cette intégration du vecteur a la multiplication anarchique des globules blancs encore indifférenciés à l’origine de la leucémie, il s'agirait donc bien d'un effet secondaire direct imputable à la stratégie elle-même. La majorité des patients impliqués dans les divers essais cliniques de ce type réalisés par le monde n'a pas (encore?) développé ce type de leucémie.
Cet essai clinique "phare" de la thérapie génique a eu plusieurs répercussions. Il a tout d'abord montré que le concept de thérapie génique était valable et qu'une stratégie de manipulation du génome pouvait avoir un impact thérapeutique. Mais il a mis aussi en évidence la nécessité d'améliorer les stratégies (utilisation de nouveaux vecteurs limitant les insertions génotoxiques, réduction de la quantité de cellules exposées au vecteur puis réinjectées au patient, afin de limiter le risque de toucher un autre gène, ...) et les risques qui pouvaient être associées à cette stratégie. Enfin, et de manière très inopportune, il a aussi fortement freiné le développement d'une thérapie génique qui commençait à souffrir d'une mauvaise réputation étant donné le peu de réussites observées dans les protocoles cliniques. Ces événements sont rentrés en synergie avec le décès d'un patient aux États-Unis en 1999, Jerry Jelsinger, lors de l'injection de fortes doses d'un vecteur dérivé d'un adénovirus, qui a ébranlé la communauté scientifique et médicale, et celui en 2007 d'un patient traité par un vecteur dérivé de AAV.
Les résultats de certains protocoles sont actuellement mis en avant avec notamment en 2007-2008 des essais cliniques sur des pathologies de la vision, ou des pathologies neuronales infantiles (LINCL ou late infantile neuronal ceroid lipofuscinosis) dans lesquels des signes positifs d'amélioration clinique sont rapportés.[14] La prudence est de mise et ces résultats restent toutefois non seulement à confirmer, mais aussi à améliorer dans l'avenir, car l'annonce d'un résultat positif n'implique pas forcément que l'on soit proche des requis thérapeutiques pour que le traitement puisse prendre sa place dans un contexte hospitalier classique.
Thérapie génique et société
Alors que la thérapie génique fonctionne bien dans le modèle animal (souris, chiens, ...), elle est le plus souvent inefficace chez l'homme en raison de la combinaison de plusieurs paramètres: l'inefficacité des vecteurs à transduire un pourcentage important de cellules, la difficulté de créer des vecteurs qui permettent de reproduire les cinétiques complexes d'expression des gènes, parfois l'utilisation de gènes thérapeutiques inadéquats en raison d'erreurs conceptuelles concernant les mécanismes de la maladie, l'état de santé de certains patients pour lesquels la thérapie génique ne pourrait de toute façon rien apporter, ... Cette inefficacité rend plus aigüe les considération éthiques, sociologiques, et sécuritaires, ... avec une question sous-jacente: les recherches doivent-elles être arrêtées? Les problèmes liés au risque de diffusion du virus vecteur dans la population, ainsi que celui d'une transmission germinale (qui conduirait à transmettre à l'enfant du malade les nouveaux gènes lors de la fécondation) sont actuellement pratiquement inexistants, et les effets secondaires , s'ils restent dramatiques au niveau humain, sont globalement très rares et ne justifient pas un arrêt des efforts de R & D. Les diverses instances impliquées dans le contrôle des essais en thérapie génique (l'AFSSAPS en France, Le RAC aux États-Unis) commencent à adopter des cadres réglementaires permettant une protection optimale du patient et de son entourage, et on peut considérer aujourd'hui que la thérapie génique n'est "pas plus risquée" que les autres approches thérapeutiques expérimentales.[15]
Un problème sociologique et éthique, classique de toute approche médicale reposant sur la biotechnologie, est celui du coût et de l'effort financier que la société consent au développement de la thérapie génique. Encore inexistant d'un point de vue commercial, le coût de la thérapie génique est actuellement assuré par les organismes publics caritatifs ou gouvernementaux, et surtout par l'industrie. Considéré comme une thérapie de pays riches, ne pouvant pas faire état d'un bilan très positif ni médicalement ni commercialement, et face aux difficultés de financement de la recherche scientifique de nombreuses voix s'élèvent pour demander une redistribution de l'argent alloué à la thérapie génique, et arrêter les investigations. Le contexte n'est dans les faits pas aussi manichéen que l'on pourrait imaginer. Par exemple, si le développement de la thérapie génique est le fait de pays riches, certaines études basent leur concept sur l'utilisation de vecteurs de type ADN nu (non viraux) qui pourraient être facilement produits, stockés, envoyés et de coût relativement bas permettant ainsi à des pays pauvres d'accéder à des traitements qui aujourd'hui reposent sur des approches médicamenteuses lourdes au niveau financier.
Voir aussi
Références
- ↑ Joshua Lederberg et Edward Tatum, Reflections on Research and the Future of Medicine, Columbia University, 1966.
- ↑ Réflexions sur l'avenir de la thérapie génique.Heard, JM;Danos, O;Peschanski, Médecine/sciences, 2000, vol.16, n°12, pp.1305-9
- ↑ Claude Bagnis « La Recherche, Hors Série », Juillet 2003, Les Chausses-trappes de la thérapie génique.
- ↑ Journal of Gene Medicine, Wiley Intersciences
- ↑ « Organisme génétiquement modifié (OGM) » : un organisme, à l'exception des êtres humains, dont le matériel génétique a été modifié d'une manière qui ne s'effectue pas naturellement par multiplication et/ou par recombinaison naturelle. » ,Directive 2001/18/CE du Parlement européen et du Conseil[1]
- ↑ Campos SK, Barry MA. Current advances and future challenges in Adenoviral vector biology and targeting. Curr Gene Ther. 2007 Jun;7(3):189-204.
- ↑ Trono D. Lentiviral vectors: turning a deadly foe into a therapeutic agent. Gene Ther. 2000 Jan;7(1):20-23.
- ↑ Carter BJ. Adeno-associated virus vectors in clinical trials. Hum Gene Ther. 2005 May;16(5):541-50.
- ↑ Therapy on trial. Virginia Hughes. Nature Medicine. 2007 Volume 13 Number 9, pp 1008-1009
- ↑ Travaux de l'école de médecine de l'université Jikei (Préfecture de Chiba)
- ↑ Namiki Yoshihisa & al. ; "A novel magnetic crystal-lipid nanostructure for magnetically guided in vivo gene delivery" ; Nature Nanotechnology - publié en ligne le 23 août 2009
- ↑ Gene Therapy of Human Severe Combined Immunodeficiency (SCID)-X1 Disease. Marina Cavazzana-Calvo, Salima Hacein-Bey, Geneviève de Saint Basile, Fabian Gross, Eric Yvon, Patrick Nusbaum, Françoise Selz, Christophe Hue, Stéphanie Certain, Jean-Laurent Casanova, Philippe Bousso, Françoise Le Deist, and Alain Fischer. Science 28 April 2000: Vol. 288. no. 5466, pp. 669 - 672.
- ↑ LMO2-associated clonal T cell proliferation in two patients after gene therapy for SCID-X1 S. Hacein-Bey-Abina et al. A. Fischer, M. Cavazzana-Calvo. Science 17 October 2003: Vol. 302. no. 5644, pp. 415 - 419.
- ↑ Wilson JM, Gansbacher B, Berns KI, Bosch F, Kay MA, Naldini L, Wei YQ. Good news on the clinical gene transfer front. Hum Gene Ther. 2008 May;19(5):429-30.
- ↑ Le contrôle de la qualité des produits de thérapie génique: approche de l'AFSSAPS. Chenivesse X;Ridoux V;Tissier MH. médecine/sciences, 2003, vol.19, n°4, pp.481-8
Liens externes
- (en) Gene Therapy: Molecular Bandage? University of Utah's Genetic Science Learning Center
- (en) The American Society of Gene Therapy
- (en) The European Society of Gene Therapy
- (en) Gene Therapy Clinical Trials Worldwilde
- (en) Le site du Genethon à Evry
- Portail de la médecine
Catégories : Biologie moléculaire | Génétique appliquée | Recherche médicale | Bioéthique
Wikimedia Foundation. 2010.